Molekule - stabilna jedinjenja atoma - nastaju zbog činjenice da su atomi u stanju da "dijele" elektrone jedni s drugima. Stabilnost molekula može se okarakterisati energijom disocijacije (ili energijom vezivanja), odnosno energijom koja se mora prenijeti na molekulu da bi se podijelila na dva dijela (kod dvoatomskih molekula, kako bi se podijelila na dva odvojena atoma ). Veličina ove energije ovisi o strukturi elektronskih omotača atoma: grubo govoreći, što atomi voljnije dijele elektrone, to je jača veza, a samim tim i veća energija disocijacije. U velikoj većini molekula veza je prilično jaka; njegova energija iznosi jedinice ili desetine elektronvolta. U pogledu makroskopskih količina, to je oko stotinu kilodžula po molu supstance, a u temperaturnim jedinicama to odgovara hiljadama i desetinama hiljada stepeni (međutim, prava disocijacija molekula počinje na mnogo nižim temperaturama). Još jedna posljedica prilično jake kemijske veze je kompaktna veličina molekula: atomi u molekulu sjede jedan do drugog na udaljenosti reda veličine samog atoma.
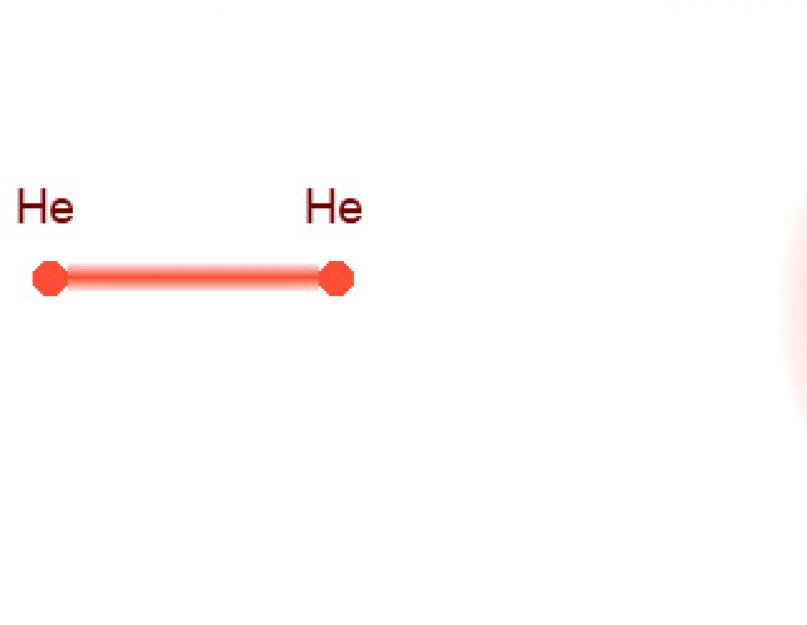
Potpuno jedinstven izuzetak od ovog uzorka je helijum dimer, He 2 molekula. Ovo je neočekivano velika molekula - prosječna udaljenost između atoma helija je mnogo veća od njihove veličine. Zbog toga, helijum dimer ima izuzetno malu energiju vezivanja, oko desetine mikroelektronvolta! Takav se molekul ne raspada samo na sobnoj temperaturi, već i na temperaturama do milikelvina. S pravom se može reći da je ovo danas najkrhkiji molekul.
Zbog svoje krhkosti, molekul He 2 je teško eksperimentalno proučavati. Svaki standardni način proučavanja molekula (osvijetliti ga svjetlom, ozračiti ga elektronima, čak i samo položiti na površinu) će ga odmah uništiti. Sve što možete učiniti je dobiti ultra-hladni tok helijuma, u kojem će se neki od atoma helija spojiti u dimere, i registrirati protok molekula He 2 senzorom (u stvari, ovo nije tako jednostavno: helijum dimer je prvi put registrovan 1993. godine). Postavlja se netrivijalno pitanje: kako odrediti veličinu ovog molekula u takvoj situaciji, odnosno kako izmjeriti dužinu He-He hemijske veze ako se molekul raspadne i pri najmanjem poremećaju?
Zadatak
Sjetite se postavljanje eksperimenta koji bi nam omogućio da odredimo veličinu molekule dimera helijuma.
Clue
Do danas je izmišljeno nekoliko načina za mjerenje ove veličine. Jedan od njih je čisto geometrijski, a drugi koristi najjednostavnija kvantna svojstva materije. Za svaki slučaj, objasnimo da molekulu He 2 treba zamisliti ne u obliku uobičajene „bučice“, u kojoj su dva manje ili više lokalizovana atoma razdvojena velikom razdaljinom (slika 2, lijevo), već u oblik velikog sfernog oblaka u kojem su dva atoma helijuma (slika 2, desno).

Rješenje

Najjednostavniji eksperiment za određivanje veličine molekula He 2 je propuštanje hladne struje helijuma kroz fino sito sa poznatim veličinama oka (slika 3). Molekula helijum dimera može nesmetano letjeti kroz ćeliju sita samo ako joj centar mase padne unutar isprekidanog kvadrata. U suprotnom, molekul će “udariti” u sito i raspasti se od udara na pojedinačne atome. Mjerenjem kako se efektivna veličina ćelije za He 2 razlikuje od stvarne geometrijske veličine (a to se može učiniti poređenjem vjerovatnoća prolaska atomskog helijuma i njegovog dimera), može se odrediti veličina molekula.
Druga metoda, koja koristi kvantna svojstva materije, je proučavanje difrakcije ovih molekula na difrakcijskoj rešetki nano veličine. Molekuli materije, poput svjetlosti, imaju valna svojstva i stoga su sposobni da iskuse difrakciju. Difrakcija na rešetki dovodi do činjenice da kretanje svjetlosti (ili čestica) odstupa od pravolinijskog pod određenim uglovima - dobijaju se difrakcijski vrhovi (vidi sliku 4). Zakon prema kojem intenzitet ovih pikova opada sa povećanjem ugla određen je efektivnom širinom jaza, koji je za molekule dimera helijuma manji od stvarne širine. Ova zavisnost se takođe može meriti i iz toga se može izvesti veličina molekula.

Pogovor
Molekularna veličina dimera helijuma bila je 1995. godine. Eksperimenti su izvedeni prvom metodom, a koristili su čitav set mlaznica sa rupama od 98 do 410 nm. Mjerenja su pokazala da je prosječna udaljenost između atoma helijuma u dimeru 62 ± 10 angstroma. Ovo je apsolutno gigantska vrijednost za atomsku fiziku; Podsjetimo da je promjer jednog atoma helijuma manji od 1 angstrema!
Druga tehnika je eksperimentalno implementirana 2000. godine i dala je nešto manju i precizniju vrijednost od 52 ± 4 angstrema. Imajte na umu da je ova metoda, na neki način, nedestruktivna: čak i takvi krhki molekuli odstupaju od prvobitnog smjera kretanja bez raspadanja, zbog svojih valnih svojstava.
Ovdje je korisno još jednom pogledati Sl. 2. Činjenica da je prosječna udaljenost između atoma helijuma u dimeru približno 52 angstroma ne znači da atomi rotiraju jedan u odnosu na drugog na točno toj udaljenosti. Zapravo, dva atoma su rasprostranjena na vrlo širokom rasponu udaljenosti: od nekoliko do nekoliko stotina (!) angstroma. Na sl. Na slici 5 prikazana je teorijski izračunata valna funkcija dimera kao funkcija međuatomske udaljenosti. Zanimljivo je primijetiti da tako anomalno široka i asimetrična raspodjela dovodi do činjenice da se prosječna (tj. ponderirani prosjek) međuatomska udaljenost uopće ne poklapa s najvjerojatnijim rastojanjem (na kojem valna funkcija ima maksimum).

Ovako razmazana molekula je potpuno neobična pojava za atomsku fiziku, pa su eksperimentatori dugo tražili način ne samo da izmjere prosječnu međuatomsku udaljenost, već i da ispitaju sam profil valne funkcije. To je učinjeno sasvim nedavno, prošle godine, uz pomoć takozvane Kulonove eksplozije molekula. Kada molekul apsorbira foton, jedan ili više elektrona se brzo izbacuju iz njega. U ovom slučaju, bilo je moguće izbaciti po jedan elektron iz svakog atoma helija pomoću jednog fotona. Kao rezultat toga, od hemijske veze nije ostao ni trag: dva jona helijuma počela su se snažno odbijati i raspršivati u različitim smjerovima. Na osnovu uglova i brzina emisije elektrona i jezgara moguće je rekonstruisati stanje u kojem su jezgra bila u trenutku jonizacije.
Posljednja zanimljiva stvar koju ovdje vrijedi spomenuti odnosi se na izotope helijuma. Svi opisani eksperimenti izvedeni su sa helijumom-4. Lakši izotop helijuma, helijum-3, uopšte ne stvara dimere. Hemijska veza He-He u njemu je ista, ali je kvantna vibracija atoma helijuma-3 jača, pa stoga oni ne mogu ostati zajedno. Da bi se atomi helija-3 držali u kompaktnom klasteru, potrebna su ne dva, ne tri, ne četiri, već otprilike 30 atoma. Tek tada je njihova međusobna privlačnost dovoljno jaka da zadrži atome zajedno. Poetički rečeno, možemo reći da je helijum-3 supstanca koja ne počinje od molekula, već od kapljica.
Parfem Molecule 02 smatra se jednim od najpoznatijih među selektivnim parfimerijskim aromama. Napravljene na samo jednoj centralnoj noti, pogodne su i za muškarce i za žene.
Molekul arome 02
Parfem Molecule Eccentric 02 pušten je u prodaju 2008. godine i od tada se ne skida s polica. Njihov kreator, parfimer Geza Schoen, kreirao je aromu oko centralne note - molekule ambroskana ili ambra, po kojoj je parfem dobio ime. Parfem je pozicioniran kao i dostupan je u bočicama od 30, 50 i 100 ml. Ako želite da testirate Molecule 02 parfem u prodavnici, bolje je zamoliti konsultanta da vam kapne kapljicu parfema na ruku, a zatim prošetate s njom neko vrijeme. Tek tada ćete moći osjetiti kako se aroma širi. U suprotnom vam se na test traci može učiniti da parfem uopće nema miris.
Inovacija kompozicije parfema Molecule No. 2 leži u činjenici da je nemoguće razlikovati tri tradicionalna parfemska akorda u njegovom sastavu. Redoslijed otvaranja, u kojem prvo dolaze gornje note, zatim srednje note - note "srca" - i na kraju čujete posljednje početne, ali najduže preostale osnovne note, ovdje je prekinut. U ovom selektivnom parfemu na koži uvijek osjetite glavnu komponentu koja, ovisno o različitim uvjetima, može različito zvučati. Sastav molekula arome 2 može se predstaviti na sljedeći način:
- centralna nota: ambroscan;
- dodatne napomene: bor, ambrinol, drvene note.
Molekul parfema 1 ili 2?

Nešto ranije od Molecules 02, u kolekciju mirisa ovog poznatog parfimera našao se i parfem Molecule 01. Mnogi se prilikom kupovine suočavaju s potrebom da biraju između ova dva očaravajuća i neobična mirisa. Vjeruje se da je Molecule 01 lakši i ljetni miris, a Molecule 02 zimski i teži. Zaista, aroma Molecule 02 najjače se otkriva u kontrastu tople kože i hladnog ledenog zraka, kao i nakon prelaska sa ulice u toplu prostoriju. Ovaj parfem je gušći, zasićeniji, jače je drvenaste i jantarne kompozicije. U hladnoj sezoni ne zvuči previše zagušljivo ili nametljivo, već se otkriva u svom sjaju, grijući vlasnika parfema svojom aromom; .
MOSKVA, 26. septembar – RIA Novosti, Tatjana Pičugina. Sredinom prošlog stoljeća, austrijski fizičar Erwin Schrödinger je prvi pokušao da objasni fenomen života pomoću kvantne mehanike. Sada se nakupilo dovoljno podataka za izgradnju hipoteza o tome kako nastaju kvantni efekti u tijelu i zašto su uopće tamo potrebni. RIA Novosti govori o najnovijim dostignućima u kvantnoj biologiji.
Schrödingerova mačka je vjerovatno živa
U knjizi “Šta je život sa stanovišta fizike?”, objavljenoj 1945. godine, Schrödinger opisuje mehanizam naslijeđa, mutacije na nivou atoma i molekula kroz kvantnu mehaniku. To je doprinijelo otkriću strukture DNK i ohrabrilo biologe da stvore vlastitu teoriju, zasnovanu na strogim fizičkim principima i eksperimentalnim podacima. Međutim, kvantna mehanika i dalje ostaje izvan svog djelokruga.
Ipak, kvantni pravac u biologiji nastavlja da se razvija. Njegovi sljedbenici aktivno traže kvantne efekte u reakcijama fotosinteze, fizičkom mehanizmu mirisa i sposobnosti ptica da osjete magnetsko polje Zemlje.
fotosinteza
Biljke, alge i mnoge bakterije dobijaju energiju direktno od sunčeve svetlosti. Da bi to učinili, oni imaju posebne antene u svojim ćelijskim membranama (kompleksi za prikupljanje svjetlosti). Odatle, kvant svjetlosti ulazi u reakcioni centar unutar ćelije i pokreće kaskadu procesa koji na kraju sintetiziraju ATP molekul - univerzalno gorivo u tijelu.
Naučnici ističu da se konverzija svjetlosnih kvanta odvija vrlo efikasno: svi fotoni padaju sa antena u reakcioni centar koji se sastoji od proteina. Postoji mnogo puteva koji vode tamo, ali kako fotoni biraju najbolji? Možda koriste sve puteve odjednom? To znači da moramo dozvoliti superpoziciju različitih stanja fotona jedno na drugo – kvantna superpozicija.
Eksperimenti su sprovedeni sa živim sistemima u epruvetama koje su pobuđivali laseri da bi se posmatrala kvantna superpozicija, pa čak i neka vrsta "kvantnog bita", ali rezultati su bili kontradiktorni.
© Ilustracija RIA Novosti. Alina Polyanina, Depositphotos
© Ilustracija RIA Novosti. Alina Polyanina, Depositphotos
Kompas za ptice
Ptica zvana Godwit leti bez zaustavljanja od Aljaske do Novog Zelanda preko Tihog okeana - 11 hiljada kilometara. I najmanja greška u pravcu koštala bi je života.
Utvrđeno je da se ptice orijentišu prema Zemljinom magnetskom polju. Neke vrste migratornih pesama osećaju smer magnetnog polja sa tačnošću do pet stepeni.
Kako bi objasnili jedinstvene navigacijske sposobnosti, naučnici su postavili hipotezu o ugrađenom kompasu za ptice, koji je čestice magnetita u tijelu.
Prema drugoj tački gledišta, retina ptičjeg oka ima posebne receptorske proteine koji se uključuju kada su izloženi sunčevoj svjetlosti. Fotoni izbacuju elektrone iz proteinskih molekula, pretvarajući ih u slobodne radikale. Oni dobijaju naboj i, poput magneta, reaguju na magnetsko polje. Njegova promjena je sposobna da prebaci par radikala između dva stanja koja postoje kao da istovremeno. Pretpostavlja se da ptice osjećaju razliku u tim "kvantnim skokovima" i prilagođavaju kurs.
Miris
Osoba može razlikovati hiljade mirisa, ali fizički mehanizmi mirisa nisu u potpunosti poznati. Jednom na sluznici, molekul mirisne tvari susreće se s proteinskim molekulom, koji ga nekako prepoznaje i šalje signal nervnim stanicama.
Postoji oko 390 poznatih tipova ljudskih olfaktornih receptora, koji kombinuju i percipiraju sve moguće mirise. Vjeruje se da je mirisna tvar poput ključa koji otvara bravu receptora. Međutim, molekul mirisa se ne mijenja kemijski. Kako ga receptor prepoznaje? Očigledno on osjeća nešto drugo u ovom molekulu.
Naučnici su predložili da elektroni tuneliraju (prolaze energetske barijere bez dodatne energije) kroz molekule mirisa i nose neku vrstu informacijskog koda do receptora. Pokušaji odgovarajućih eksperimenata na voćnim mušicama i pčelama još nisu dali jasne rezultate.
“Ponašanje bilo kojeg složenog sistema, posebno žive ćelije, određeno je mikroskopskim procesima (hemija), a takvi procesi se mogu opisati samo kvantnom mehanikom. Drugo pitanje je koliko je ovaj opis efikasan Danas se kvantna mehanika složenih sistema naziva kvantnom informatičkom naukom još uvek je u povoju“, komentariše za RIA Novosti Jurij Ožigov, član katedre za superkompjutere i kvantne informacione nauke na Fakultetu računarskih nauka i tehnologije Moskovskog državnog univerziteta.
Profesor smatra da je napredak u kvantnoj biologiji sputan činjenicom da su savremeni fizički instrumenti dizajnirani za nežive objekte te je uz njihovu pomoć problematično izvoditi eksperimente na živim sistemima.
„Nadam se da su to privremene poteškoće“, zaključuje on.
Na udaljenosti između atoma koja odgovara dužini kemijske veze, odnosno na udaljenosti koja se nalazi u stvarnom molekulu, vezni MO je uvijek niže energije od pojedinačnih atoma, a antivezujući MO je uvijek veći. Ovo je rigorozan rezultat koji proizlazi iz zakona kvantne mehanike. Dobra je aproksimacija reći da je smanjenje energije na veznom MO jednako povećanju energije na MO protiv vezivanja.
Na sl. Slika 12.6 je jednostavan dijagram koji pokazuje kako se atomske orbitale kombinuju da formiraju molekularne orbitale. Ove vrste dijagrama ćemo koristiti u narednim poglavljima. Dva atomska 1 s-orbitale - po jedna za svaki H atom - prikazane su lijevo i desno na slici. Linije koje prolaze kroz njih su nulti energetski nivo za molekularne orbitale, odnosno ove linije odgovaraju energiji atoma kada su toliko udaljeni da se međusobno ne mogu osjetiti. U centru su prikazani energetski nivoi veznih i antivezujućih MO-ova. Oni su određeni b u slučaju vezne orbitale ( b- sa engleskog vezivanje) * povezivanje atomskih orbitala sa MO pokazuje da se obje atomske orbitale kombinuju i proizvode dva MO kada atomi formiraju molekul.
Rice. 12.6.Dijagram nivoa energije koji predstavlja kombinaciju dvije atomske 1s orbitale u vezni i antivezujući MO kada su atomi razdvojeni rastojanjem jednakom dužini kemijske veze r 0, što odgovara energetskom minimumu za vezni MO. Vezni MO ima nižu energiju od atomskih orbitala, a antivezujući MO je isto tako veći po energiji. Obvezujući MO je označen b , a labavljenje MO je *
Dijagram nivoa energije MO prikazan na sl. Slika 12.6 prikazuje dva energetska stanja uključena u formiranje molekula vodonika. Međutim, još nismo "naselili" dva elektrona. Ovaj dijagram je sličan dijagramu energetskog nivoa atoma sa više elektrona (vidi sliku 11.1). Dati su nam energetski nivoi, ali da bismo razumeli šta će se dogoditi, još uvek moramo da rasporedimo elektrone po njima. Postoje dva elektrona - po jedan iz svakog atoma vodika. Znamo da se elektroni nalaze na najnižem dostupnom energetskom nivou sve dok broj elektrona ne krši Paulijev princip, odnosno svaka orbitala može sadržavati najviše dva spin uparena elektrona. Ovo se odnosi na MO kao i na atomske orbitale.
b i imaju uparene leđa. Kada su atomi udaljeni jedan od drugog, elektroni imaju energiju koja odgovara linijama atoma 1 s-orbitale. Vezni MO ima znatno nižu energiju. Upravo to smanjenje energije osigurava integritet molekula. Dva elektrona su u molekularnoj orbitali. Nijedan od njih nije povezan sa određenim atomom. Kovalentna veza uključuje dijeljenje elektrona između atoma.

Rice. 12.7. Dijagram MO molekule vodonika. Dva elektrona (strelice), po jedan iz svakog atoma vodonika, zauzimaju najniži energetski nivo, a njihovi spinovi su upareni. Njihova energija je niža od energije pojedinačnih atoma. Tako se zbog dijeljenja elektrona formira veza
Zašto molekul helijuma He 2 ne postoji? Svaki od dva pojedinačna atoma He ima 1 s-orbitale imaju dva elektrona. Stoga će MO dijagram biti isti kao na sl. 12.6. Međutim, sada moramo rasporediti četiri elektrona po energetskim nivoima MO. Na sl. Slika 12.8 prikazuje dijagram MO sa četiri elektrona. Prvi elektron je naseljen u vezni MO jer je to stanje najniže energije. Drugi elektron također slijeće na vezni MO sa spinom suprotnim od prvog. Paulijev princip kaže da dva elektrona ne mogu imati sve iste kvantne brojeve. Dva elektrona na veznom MO imaju različite spin kvantne brojeve: s =+ 1/2 i s =- 1/2. Postoje samo ove dvije vrijednosti spin kvantnog broja, tako da treći elektron ne može doći do veznog MO. Mora zauzeti sljedeći energetski nivo, koji je predstavljen labavim MO. Četvrti elektron takođe može zauzeti antivezujući MO sa suprotnim spinom. Dva elektrona na veznom MO imaju nižu energiju nego u pojedinačnim atomima, ali dva elektrona na veznom MO podižu energiju točno onoliko koliko je vezni elektroni spuštaju. Kao rezultat toga, nema smanjenja energije u poređenju sa pojedinačnim atomima. Integritet molekula je osiguran činjenicom da vezani atomi imaju nižu energiju od pojedinačnih atoma. U slučaju atoma helija ne dolazi do smanjenja energije koje bi dovelo do stvaranja stabilne konfiguracije, pa stoga ne dolazi do veze. U sljedećem poglavlju ćemo pogledati slično ponašanje plemenitog plina neona.

Rice. 12.8. MO dijagram hipotetičke molekule helija. Postoje četiri elektrona (strelice), po dva iz svakog atoma helijuma. Dva od njih zauzimaju vezni MO. Ostala dva, po Paulijevom principu, šalju se na labavi MO. Općenito, nema smanjenja energije i stoga ne dolazi do povezivanja
Za procjenu prediktivnih mogućnosti jednostavnih grafikona poput onih prikazanih na Sl. 12.7 i 12.8, razmotrite četiri moguća molekula. To su molekularni ion vodonika H 2 + , molekul vodonika H 2 , molekularni ion helijuma He 2 + i molekul He 2 . Molekularni ion H 2 + sastoji se od dva jezgra vodika (protona) i jednog elektrona. Kao i monoatomski kation Na +, pozitivno je nabijen jer ima jedan elektron manje od protona. He 2+ je molekularni ion koji se sastoji od dva jezgra helijuma (po dva protona) i tri elektrona. Dakle, ima četiri pozitivno nabijene čestice (četiri protona) i tri negativno nabijena elektrona.
Na sl. Slika 12.9 prikazuje dijagram nivoa energije MO za ova četiri molekula. Nivoi atomske energije su izostavljeni. Molekularni jon H 2 + ima samo jedan elektron, tako da zauzima najniži energetski nivo, vezni MO. Energija je niža od one razdvojenih atoma, ali samo za iznos približno upola manji od količine H 2 molekule, koja ima dva elektrona na veznom MO. Molekul H2 ima potpunu kovalentnu vezu. Kaže se da ima red veze 1. Molekularni jon H 2+ ima red veze 1/2.

Rice. 12.9.Dijagram nivoa energije MO za četiri molekula: molekularni vodikov jon H2+ , molekule vodonika H 2 , molekularni jon helijuma He2+ i molekule On 2
Molekularni ion He 2+ ima tri elektrona. Prva dva od njih se nalaze na veznom MO, ali zbog Paulijevog principa, treći elektron se mora postaviti na antivezujući MO. Dva elektrona smanjuju energiju u odnosu na razdvojene atome, ali treći elektron povećava ovu energiju. Sveukupno dolazi do smanjenja energije. Molekularni ion He 2+ postoji u prirodi i ima red veze 1/2. Kao što je već spomenuto, molekul He 2 ima dva vezana elektrona i dva antivezujuća elektrona. Ne postoji veza, odnosno red povezivanja je nula. Molekul He 2 ne postoji.
U tabeli Slika 12.1 pruža kvantitativne informacije o ova četiri molekula. On daje broj veznih elektrona, broj elektrona koji se ne vezuju i konačni rezultat, jednak razlici između broja veznih elektrona i broja elektrona koji se ne vezuju. Tabela također pokazuje redosljed komunikacije. Posljednje dvije kolumne su posebno zanimljive.
Tabela 12.1.Svojstva molekularnog vodikovog jona H2+ , molekule vodonika H 2 , molekularni jon helijuma He2+ i molekule On 2
Komunikacija elektroni, Res. elektroni, razlika, red veze, dužina veze, energija veze
H2:2; 0; 2; 1; 0.74A; 7,2 10 -19 J
H2+: 1; 0; 1; 1/2 ; 1.06A; 4.2 10 -19 J
On 2 + : 2; 1; 1; 1/2 ; 1.08A; 5.4 10 -19 J
On 2:2; 2; 0; 0; No; br
Podaci dati u tabeli. 12.1 su rezultati eksperimentalnih mjerenja. Prije svega, pogledajmo dužinu hemijske veze. Izražava se u angstromima (1 A = 10 -10 m). Molekularni ion H 2 + ima vezu reda 1/2 i dužinu hemijske veze od 1,06 A. Za poređenje, imajte na umu da molekula H 2 ima punu vezu reda 1 i dužinu hemijske veze od 0,74 A. Dodatni elektron na veznom MO u H molekuli 2 drži atome čvršće i stoga bliže. Molekularni jon He 2+ ima vezu reda 1/2 i dužinu hemijske veze od 1,08 A, što je samo nešto veće od one kod molekularnog jona H 2+. Naravno, He 2 nije molekul i stoga nema hemijsku vezu. Posljednja kolona prikazuje energiju vezivanja u jedinicama od 10 -19 J. Zanimljiva je relativna snaga veze. Molekul H 2 govori da li će veza postojati i daje informaciju o tome koliko će ona biti jaka.
U ovom poglavlju koristili smo koncept molekularnih orbitala da pogledamo najjednostavnije molekule. Diskusija se odnosila samo na atome koji sadrže 1 s-elektroni. Svi ostali atomi i molekuli sadrže više elektrona i više orbitala. Sledeće poglavlje će koristiti ideje predstavljene ovde za analizu dvoatomskih molekula koji sadrže veće atome, kao što su molekul kiseonika O 2 i molekul azota N 2 . Ova dva molekula su glavne komponente zraka koji udišemo.
Parfimerija za ženu je sastavni dio života. Završni dodir, bez kojeg nijedna slika ne bi bila potpuna. Odabir vlastitog mirisa nije lak zadatak, ali na svijetu postoje parfemi koji će sami izabrati vlasnika! U okeanu različitih kompozicija, uvijek želiš pronaći nešto svoje, draga, ali na ulicama ima puno ljudi sa istim parfemom (). Naći se na istoj zabavi za dvije dame s istim mirisom jednako je neugodno kao i nositi identične haljine. Ali postoje parfemi koji će za svakog stvoriti samo njen miris - jedinstveni buket, jedini na celoj planeti! Pričaćemo o Molecule parfemu.
Mnogi ljudi, kada se prvi put susreću s escentričnim molekulima, skeptično sliježu ramenima. Teško je povjerovati da Molecule parfem, čija je cijena u granicama uobičajenih za brendirane parfeme, može učiniti čuda uzimajući individualan miris. Međutim, ova magija je objašnjiva i njeno ime je nauka!
Čudo ima i ljudskije ime - Geza Schoen (njem. Geza Schoen). Riječ je o njemačkom parfimeru koji je do 2006. godine završio stvaranje molekule koju je nazvao “ISO E Super”. Godina je bila prekretnica, prekretnica u istoriji parfimerije - vreme kada se rodio parfem Molecule, koji je mirisao na svaku osobu!
Stvaranje magičnog molekula bilo je teško i trebalo je nekoliko godina rada. Mnogo je lakše objasniti princip njegovog rada. Svaka osoba ima mnoge karakteristike koje su jedinstvene za njega. Ima ih i koža, uključujući mikroskopske hlapljive tvari koje se neprestano oslobađaju s njene površine, ali nisu uočljive za obične ljude. ISO E Super ih prepoznaje!
Reagujući, molekul daje komandu ostalim sastojcima i formira se jedinstvena parfemska kompozicija. Kao rezultat toga, dva prijatelja koji stoje jedan pored drugog i nose isti Molecule parfem mirisaće drugačije. Svi Molecule parfemi, serija od šest mirisa, izgrađeni su na ovom principu.
Molekul se aktivira na bilo kojem dijelu kože, ali najveći učinak može se postići nanošenjem parfema u blizinu sekretornih područja - zapešća, dekoltea ili nabora laktova.
Postoji još jedna karakteristika Molecule ISO E Super. Te duboko lične, gotovo intimne sile koje Molecule parfem aktivira stvaraju mirise koji djeluju na suprotni spol s efektom pravog afrodizijaka. Nijedna dama neće proći nezapaženo sa Molecule parfemom - puno pažnje je zagarantovano.
Verovatno su svi čuli za feromone? Da, govorimo o njima – supstancama koje privlače partnere. Ima nečeg iskonskog, životinjskog, instinktivnog u tome, ali u slučaju Molecule-a oni su uokvireni u plemenite i lijepo mirisne kompozicije!
Šest mirisa iz serije Molecule
Seriju parfema Molecule objedinjuje zajednički koncept koji formira ISO E Super. Istovremeno, svaka kompozicija ima svoj karakter, koji, pomešan sa efektom „magične“ molekule, formira posebne mirise i note. Jednom na koži, aroma Molecule prvo zvuči upravo s ovom dodatnom formulom. Nakon nekoliko minuta, nakon što smo otkrili svačije lične tajne, pojavljuje se pojedinačni miris.
Da bi pravilno funkcionisali, parfemima Molecule potreban je kontakt sa kožom, pa ih treba pažljivo koristiti na odeći. Bolje je testirati Molekul na dva načina: nanošenjem na zglob i na materijal neutralnog mirisa.
Prije nego što pređemo na svaki miris iz serije Molecule, vrijedi naučiti o kvalitetama zajedničkim za sve:
- Svi mirisi u seriji su bazirani na ISO E Super efektu.
- Svaki član porodice smatra se uniseksom, ali to ne znači prosječan miris koji svima pristaje - na muškarcima će postati muški, na damama će dobiti nježnu ženstvenu strukturu.
- Parfem Molecule vole mnoge pjevačice, manekenke i glumice više puta su izrazile svoje pozitivne kritike.
- Molekul je dostupan u 100 i 30 ml, ali ovaj drugi može biti opremljen modernim crnim kućištem, ili se može prodati u običnoj kartonskoj kutiji (tzv. refil, koji se može ubaciti u prethodno kupljenu kutiju); Od toga zavisi i cena parfema.
- Klasičnu strukturu piramide nota posebno je narušio pobunjenik Geza Schoen: nema početnih, srčanih i baznih faza nota - Molekule se smatraju mono-aromama (sa izuzetkom Escentric 03).
VAŽNO: Unatoč monostrukturi, zvuk note Molecule je i dalje podijeljen na faze - barem prije i nakon trenutka formiranja jedinstvenog mirisa.
Ponekad je teško identificirati Molecule mirise. To je zbog sličnosti imena kompozicija i samog brenda. Brend se zove “Escentric Molecules” (druga riječ u množini), i mirisi uključeni u seriju:
- Molekul 01 (riječ je napisana u jednini);
- Escentric 01 (pisme slično onom u nazivu brenda);
- Molecule 02 i njegov partner Escentric 02;
- Sljedeći par: Molecule 03 i partner sa posebnim karakteristikama - Escentric 03.
Često postoje duga imena koja uključuju i naziv brenda i sam miris. Da biste izbjegli zabunu, morate obratiti pažnju na riječ ispred digitalnog koda. Kompozicije su puštane u parovima, numerisane.
Prvo nula

Ovaj prvi par porodice izašao je 2006. godine i postao je “revolucija u svijetu parfimerije”. Upravo su ga tako nazvali kritičari, koji su u početku bili prilično skeptični prema svim inovacijama. Međutim, nakon testiranja parfema, punili su sjajne časopise naslovima o “proboju”, “revoluciji” i “magiji”.
Molekul 01
Ovaj miris je izgrađen isključivo na „magiji“ ISO E Super. Sastav ne uključuje druge komponente - radi se o čistom, koncentrisanom individualnom mirisu.
| Grupe mirisa | Mošusni, cvjetni, drveni |
| Parfimer | Geza Schoen |
| Tip | Eau de Parfum |
| Compound | ISO E Super |
Escentric 01
Ovo je pravi partner prvog Molekula, ali ima i zasebnu strukturu. Odnosno, do trenutka kada se pojavi jedinstven miris, parfem ne ćuti, već zvuči svojim zanimljivim buketom nota. I tada se ne pretvara u čisti lični zvuk Molecule 01, već formira aromu iz mješavine jedinstvenog mirisa i osnovne kompozicije.
Nula sekunda

Ovaj par Molecule pojavio se 2008. godine, kada se slava o premijernim mirisima već proširila svijetom. Rezultat su redovi u radnjama na dan pojavljivanja, te gotovo trenutna prodaja svih zaliha.
Posebna karakteristika ovih kompozicija je prisustvo supstance Ambroxan, analoga ambergrisa koji je veštački sintetizovao Gez Schoen. Parfimer nije autor supstance - poznata je još od 1950-ih, ali je upravo on uspio dobiti Ambroxan u obliku jakog, svijetlog i istovremeno blagog mirisa.
Molekul 02
Ovaj predstavnik drugog para, kao i uvijek, daje ideju o najčistijem zvuku komponenti. Veoma senzualni Ambroxan i lični miris ISO E Super su veoma seksi duet!
| Grupe mirisa | Eastern |
| Parfimer | Geza Schoen |
| Tip | Eau de Parfum |
| Compound | Ambroxan i ISO E Super |
Escentric 02
Dva glavna sastojka serije dodane su dvije cvjetne note. Istovremeno, naglasak se ne pomjera na zamor, a cvijeće se vrlo skladno uklapa u cjelokupnu kompoziciju. Slatkoće ima, ali nije preterano - njen nivo je individualan i zavisi od komponenti koje igraju glavnu ulogu: Ambroxan i lični miris.
| Grupe mirisa | Orijentalni, cvjetni |
| Parfimer | Geza Schoen |
| Tip | Eau de Parfum |
| Compound | Iris, Jasmin, Ambroxan i ISO E Super |
Treća serija

Ova dva mirisa Molecule pojavila su se 2010. godine i postala možda najkontroverznija u seriji. Treća serija gotovo nikoga nije ostavila ravnodušnim - ljudi su ili mrzeli ove mirise ili su se ludo zaljubljivali u njih. Ovo je pokazatelj originalnosti!
VAŽNO: Za razliku od prethodnih Molecule parfema, bočice treće serije su veoma slične. Razlikuju se samo po malim natpisima: “M” i “Molecule 03” ili “E” i “Escentric 03”, napravljenim u gornjem lijevom uglu prednje strane. Na bocama od 30 ml natpisi glase “M-03” i “E-03”.
Glavni naglasak stavljen je na molekulu ISO E Super i vetiver, koji je mirisima dao chypre bazu. Oba parfema se značajno razlikuju, ali zajednička osnova im omogućava da se pripisuju jednom pravcu.
Molekul 03
Dva sastojka - ništa dodatno. Čista ideja autora. Ako vam ovaj miris odgovara, postat će vam pravi prijatelj dugi niz godina. Njegov je zvuk, naravno, individualan, ali sudeći po recenzijama, gotovo svi primjećuju fenomenalnu postojanost parfema.
| Grupe mirisa | Chypres |
| Parfimer | Geza Schoen |
| Tip | Eau de Parfum |
| Compound | Vetiver i ISO E Super |
Escentric 03
Partner je takođe neobično dugotrajan, a baziran je i na vetiveru i čuvenoj molekuli. Međutim, veliki buket nota pratećih sastojaka daje aromi svoj karakter, za razliku od partnera. Štaviše, u Escentricu 03 autor se vratio klasičnoj piramidi zvučnih bina.
Ostali brendovi mirisi
Pored šest opisanih Molecule parfemskih kompozicija, Gez Schoen je izdao još nekoliko parfema za svoj brend. Prvo, nekoliko ograničenih izdanja istih Molekula. Razlikuju se uglavnom po bočici, pakovanju i, naravno, cijeni.
Postoje mirisi Geza Schoena kreirani bez upotrebe “magične molekule”. Autor je želeo da dokaže da ume da kreira klasične parfeme i, kako pokazuju kritike, u tome je i uspeo.
Ljubitelji parfimera mogu se upoznati s njegovim kompozicijama poput The Beautiful Mind Series Intelligence & Fantasy, njegovog nastavka The Beautiful Mind Series Volume 2: Precisionand Grace ili potpuno drugačijim parfemom posvećenim davno preminulom njemačkom glumcu Klausu Kinskom...
Među velikim asortimanom Escentric Molecules parfema, svaka žena može odabrati svoj miris. Za to postoji sve: autorov talenat, nauka i visoka tehnologija. Postati vlasnik jedinog mirisa na svijetu - nije li to ono o čemu većina dama sanja?
Sada je odgovor poznat i dostupan - ovo je parfem Molecule; parfem koji kožu pretvara u pravog parfimera, stvarajući jedinstvene mirise!