II.1. Conformazioni (isomerismo rotazionale)
Il passaggio dall'idrocarburo organico più semplice, il metano, al suo omologo più vicino, l'etano, pone problemi di struttura spaziale, per la soluzione dei quali non è sufficiente conoscere i parametri discussi nella sezione. Infatti, senza modificare né gli angoli né la lunghezza dei legami, si possono immaginare molte forme geometriche della molecola di etano, diverse tra loro nella rotazione reciproca dei tetraedri di carbonio attorno al legame C-C che li collega. Come risultato di questa rotazione, isomeri rotanti (conformatori) . L'energia dei diversi conformeri non è la stessa, ma la barriera energetica che separa i diversi isomeri rotanti è piccola per la maggior parte dei composti organici. Pertanto, in condizioni normali, di regola, è impossibile fissare le molecole in una conformazione rigorosamente definita: di solito coesistono in equilibrio diverse forme rotazionali che si trasformano facilmente l'una nell'altra.
I metodi per rappresentare graficamente le conformazioni e la loro nomenclatura sono i seguenti. Cominciamo con la molecola di etano. Per esso si può prevedere l'esistenza di due conformazioni che differiscono al massimo in energia. Sono mostrati di seguito come proiezioni prospettiche (1) ("capre di segheria"), proiezioni laterali (2) e Le formule di Newman (3).
Nella proiezione prospettica (1a, 1b), il collegamento C-C va immaginato andando in lontananza; L'atomo di carbonio a sinistra è vicino all'osservatore e l'atomo di carbonio a destra è più lontano da lui.
Nella proiezione laterale (2a, 2b), quattro atomi di H giacciono nel piano del disegno; Gli atomi di carbonio in realtà si estendono un po' fuori da questo piano, ma di solito si ritiene semplicisticamente che si trovino anche nel piano del disegno. I legami “audaci” a forma di cuneo mediante l'ispessimento del cuneo indicano un'uscita dal piano verso l'osservatore dell'atomo a cui è rivolto l'ispessimento. I collegamenti tratteggiati a forma di cuneo segnano la distanza dall'osservatore.
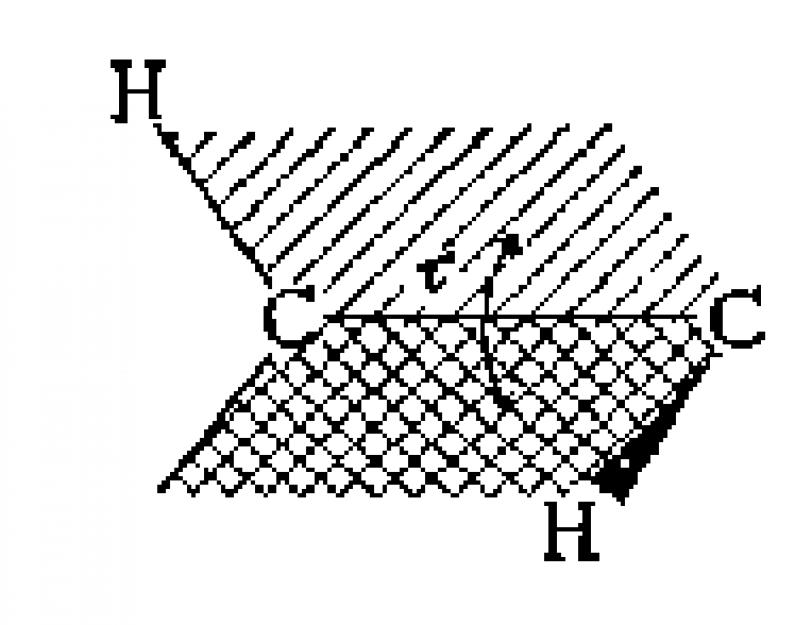
Nella proiezione di Newman (3a, 3b), la molecola è considerata lungo il legame C-C (nella direzione indicata dalla freccia nelle formule 1a, b). Tre linee divergenti con un angolo di 120° dal centro del cerchio indicano i legami dell'atomo di carbonio più vicino all'osservatore; le linee “sporgenti” da dietro il cerchio sono i legami dell'atomo di carbonio distante.
Si chiama la conformazione mostrata a sinistra oscurato : Questo nome ci ricorda che gli atomi di idrogeno di entrambi i gruppi CH 3 sono uno di fronte all'altro. La conformazione eclissata ha aumentato l'energia interna ed è quindi sfavorevole. Si chiama la conformazione mostrata a destra inibito , il che implica che la libera rotazione attorno al legame C-C è "inibita" in questa posizione, cioè la molecola esiste prevalentemente in questa conformazione.
Viene chiamata l'energia minima richiesta per ruotare completamente una molecola attorno a un particolare legame barriera di rotazione per questo collegamento. La barriera di rotazione in una molecola come l'etano può essere espressa in termini di variazione dell'energia potenziale della molecola in funzione della variazione angolo diedro (torsione). sistemi. L'angolo diedro (denotato tau) è rappresentato nella figura seguente:

Il profilo energetico della rotazione attorno al legame CC nell'etano è mostrato nella figura seguente. La rotazione dell'atomo di carbonio "posteriore" è rappresentata dalla variazione dell'angolo diedro tra i due atomi di idrogeno mostrati. Per semplicità, i restanti atomi di idrogeno sono stati omessi. La barriera rotazionale che separa le due forme di etano è di sole 3 kcal/mol (12,6 kJ/mol). I minimi della curva di energia potenziale corrispondono a conformazioni inibite, mentre i massimi corrispondono a conformazioni occluse. Poiché a temperatura ambiente l'energia di alcune collisioni molecolari può raggiungere 20 kcal/mol (circa 80 kJ/mol), questa barriera di 12,6 kJ/mol viene facilmente superata e la rotazione nell'etano è considerata libera.

Sottolineiamo che ogni punto della curva dell'energia potenziale corrisponde ad una specifica conformazione. I punti corrispondenti ai minimi corrispondono cioè agli isomeri conformazionali i componenti predominanti in una miscela di tutte le possibili conformazioni .
Man mano che la molecola diventa più complessa, aumenta il numero di possibili conformazioni che differiscono notevolmente in termini di energia. Sì, per N-butano può essere rappresentato in sei conformazioni, che differiscono nella disposizione relativa dei gruppi CH 3, cioè rotazione attorno al collegamento centrale C-C. Di seguito, le conformazioni dell'n-butano sono rappresentate come proiezioni di Newman. Le conformazioni (ombreggiate) rappresentate a sinistra sono energeticamente sfavorevoli, nella pratica si realizzano solo quelle inibite;

Le varie conformazioni eclissate e inibite del butano non sono le stesse in termini energetici. Di seguito sono presentate le energie corrispondenti di tutte le conformazioni formate durante la rotazione attorno al legame CC centrale:



Man mano che una molecola diventa più complessa, il numero di possibili conformazioni aumenta.
Quindi, le conformazioni sono varie forme spaziali non identiche di una molecola che hanno una certa configurazione. I conformi sono strutture stereoisomeriche che si trovano in equilibrio mobile e sono capaci di interconversione ruotando attorno a legami semplici.
A volte la barriera a tali trasformazioni diventa sufficientemente alta da separare le forme stereoisomeriche (esempio: bifenili otticamente attivi;). In questi casi non si parla più di conformisti, ma di esistere realmente stereoisomeri .
II.2. Isomeria geometrica
Una conseguenza importante della rigidità di un doppio legame (l'assenza di rotazione attorno ad esso) è l'esistenza isomeri geometrici . I più comuni sono isomeri cis-trans composti della serie dell'etilene contenenti sostituenti disuguali su atomi insaturi. L'esempio più semplice sono gli isomeri del butene-2.

Gli isomeri geometrici hanno la stessa struttura chimica (lo stesso ordine dei legami chimici), differendo nella disposizione spaziale degli atomi, in configurazioni . Questa differenza crea una differenza nelle proprietà fisiche (oltre che chimiche). Gli isomeri geometrici, a differenza dei conformeri, possono essere isolati in forma pura ed esistono come sostanze individuali e stabili. La loro reciproca trasformazione richiede solitamente un'energia dell'ordine di 125-170 kJ/mol (30-40 kcal/mol). Questa energia può essere impartita mediante riscaldamento o irradiazione.
Nei casi più semplici la nomenclatura degli isomeri geometrici non presenta alcuna difficoltà: cis- le forme sono isomeri geometrici in cui sostituenti identici giacciono sullo stesso lato del piano del legame pi greco, trance- Gli isomeri hanno sostituenti identici su lati diversi del piano di legame pi greco. Nei casi più complessi viene utilizzato Nomenclatura Z,E . Il suo principio fondamentale: indicare la configurazione indicata cis-(Z, dal tedesco Zusammen - insieme) o trance-(E, dal tedesco Entgegen - di fronte) posizione deputati anziani con un doppio legame.
Nel sistema Z,E i sostituenti con numero atomico più alto sono considerati senior. Se gli atomi direttamente associati ai carboni insaturi sono gli stessi, passano al "secondo strato", se necessario, al "terzo strato", ecc.
Consideriamo l'applicazione delle regole della nomenclatura Z,E utilizzando due esempi.

| IO | II |
Cominciamo con la formula I, dove tutto è risolto dagli atomi del “primo strato”. Dopo aver sistemato i loro numeri atomici, troviamo che i sostituenti senior di ciascuna coppia (bromo nella parte superiore della formula e azoto nella parte inferiore) sono in trance-posizione, da cui la designazione stereochimica E:
 E-1-bromo-1-cloro-2-nitroetene
E-1-bromo-1-cloro-2-nitroetene
Per determinare la designazione stereochimica della struttura II, è necessario cercare le differenze negli “strati superiori”. Nel primo strato i gruppi CH 3, C 2 H 5, C 3 H 7 non differiscono. Nel secondo strato, il gruppo CH 3 ha una somma di numeri atomici pari a tre (tre atomi di idrogeno), mentre i gruppi C 2 H 5 e C 3 H 7 ne hanno 8 ciascuno. Ciò significa che il gruppo CH 3 non è considerato -. è più giovane degli altri due. Pertanto, i gruppi senior sono C 2 H 5 e C 3 H 7, è in cis-posizione; designazione stereochimica Z.
 Z-3-metileptene-3
Z-3-metileptene-3
Se fosse necessario determinare quale gruppo è più vecchio - C 2 H 5 o C 3 H 7, si dovrebbe andare agli atomi del "terzo strato" la somma dei numeri atomici in questo strato per entrambi i gruppi sarebbe uguale; rispettivamente a 3 e 8, vale a dire C3H7 è più vecchio di C2H5. Nei casi più complessi di determinazione della precedenza, è necessario tenere conto di condizioni aggiuntive, come ad esempio: un atomo collegato da un doppio legame viene contato due volte, collegato da un triplo legame - tre volte; Tra gli isotopi, quello più pesante è più vecchio (il deuterio è più vecchio dell'idrogeno) e alcuni altri.
Si noti che la notazione Z Non sono sinonimi cis- le designazioni, come le designazioni E, non sempre corrispondono alla posizione trance-, Per esempio:

cis- 1,2-dicloropropene-1 cis- 1,2-dicloro-1-bromopropene-1
Z-1,2-dicloropropene-1 E-1,2-dicloro-1-bromopropene-1
Compiti di controllo
1. Bombicolo - un feromone (attrattivo sessuale) del baco da seta - è E-10-Z-12-esadecadienolo-1. Disegna la sua formula strutturale.
2. Assegnare un nome ai seguenti composti utilizzando la nomenclatura Z,E:

II.3. Isomeria ottica (enantiomerismo)
Tra i composti organici esistono sostanze in grado di ruotare il piano di polarizzazione della luce. Questo fenomeno è chiamato attività ottica e le sostanze corrispondenti lo sono otticamente attivo . Le sostanze otticamente attive si presentano in coppie antipodi ottici - isomeri, le cui proprietà fisiche e chimiche sono identiche in condizioni normali, ad eccezione di una cosa: il segno di rotazione del piano di polarizzazione. (Se uno degli antipodi ottici ha, ad esempio, una rotazione specifica [NOTA 1] +20 o, allora l'altro ha una rotazione specifica di -20 o).
II.4. Formule di proiezione
Per un'immagine convenzionale di un atomo asimmetrico su un piano, utilizzare formule di proiezione di E. Fisher . Si ottengono proiettando su un piano gli atomi a cui è associato l'atomo asimmetrico. In questo caso, l'atomo asimmetrico stesso viene solitamente omesso, conservando solo le linee che si intersecano e i simboli sostituenti. Per ricordare la disposizione spaziale dei sostituenti, nelle formule di proiezione viene spesso mantenuta una linea verticale spezzata (i sostituenti superiore e inferiore vengono rimossi oltre il piano del disegno), ma spesso ciò non viene fatto. Di seguito sono riportati diversi modi per scrivere la formula di proiezione corrispondente al modello di sinistra nella figura precedente:

Ecco alcuni esempi di formule di proiezione:

(+)-alanina (-)-butanolo (+)-gliceraldeide
I nomi delle sostanze indicano i loro segni di rotazione: ciò significa, ad esempio, che l'antipodo mancino del butanolo-2 ha configurazione spaziale , espresso proprio dalla formula sopra, e la sua immagine speculare corrisponde al butanolo-2 destrogiro. Definizione della configurazione antipodi ottici viene effettuata sperimentalmente [NOTA 3].
In linea di principio, ogni antipodo ottico può essere rappresentato con dodici (!) diverse formule di proiezione, a seconda di come è posizionato il modello durante la proiezione e da quale lato lo guardiamo. Per standardizzare le formule di proiezione sono state introdotte alcune regole per la loro scrittura. Pertanto, la funzione principale, se è alla fine della catena, è solitamente posizionata in alto, la catena principale è raffigurata verticalmente.
Per confrontare formule di proiezione scritte “non standard”, è necessario conoscere le seguenti regole per trasformare le formule di proiezione.
1. Le formule possono essere ruotate di 180° nel piano del disegno senza modificarne il significato stereochimico:

2. Due (o qualsiasi numero pari) riarrangiamenti di sostituenti su un atomo asimmetrico non cambiano il significato stereochimico della formula:

3. Una (o qualsiasi numero dispari) permutazioni di sostituenti nel centro asimmetrico porta alla formula per l'antipodo ottico:

4. Una rotazione di 90° nel piano di disegno trasforma la formula in una formula antipodale, a meno che allo stesso tempo non venga modificata la condizione per la posizione dei sostituenti rispetto al piano di disegno, cioè non considerare che ora i sostituenti laterali si trovano dietro il piano di disegno, e quelli superiore e inferiore sono davanti ad esso. Se utilizzi una formula con una linea tratteggiata, l'orientamento modificato della linea tratteggiata ti ricorderà direttamente questo:

5. Invece delle permutazioni, le formule di proiezione possono essere trasformate ruotando tre sostituenti qualsiasi in senso orario o antiorario; il quarto sostituente non cambia posizione (questa operazione equivale a due permutazioni):

6. Le formule di proiezione non possono essere derivate dal piano del disegno (cioè non è possibile, ad esempio, esaminarle "alla luce" dal retro del foglio - in questo caso il significato stereochimico della formula cambierà).
II.5. Racemati
Se la formula di una sostanza contiene un atomo asimmetrico, ciò non significa che tale sostanza avrà attività ottica. Se durante una reazione normale (sostituzione nel gruppo CH 2, aggiunta a un doppio legame, ecc.) si forma un centro asimmetrico, la probabilità di creare entrambe le configurazioni agli antipodi è la stessa. Pertanto, nonostante l'asimmetria di ogni singola molecola, la sostanza risultante risulta otticamente inattiva. Questo tipo di modificazione otticamente inattiva, costituita da una quantità uguale di entrambi gli antipodi, viene chiamata racemati [NOTA 4] .
II.6. Diastereomerismo
I composti con diversi atomi asimmetrici hanno caratteristiche importanti che li distinguono dalle sostanze otticamente attive più semplici precedentemente discusse con un centro di asimmetria.
Supponiamo che in una molecola di una certa sostanza ci siano due atomi asimmetrici; Chiamiamoli condizionatamente A e B. È facile vedere che sono possibili molecole con le seguenti combinazioni:
Le molecole 1 e 2 sono una coppia di antipodi ottici; lo stesso vale per una coppia di molecole 3 e 4. Se confrontiamo le molecole di diverse coppie di antipodi - 1 e 3, 1 e 4, 2 e 3, 2 e 4 - tra loro, vedremo che le coppie elencate non sono antipodi ottici: la configurazione di un atomo asimmetrico è la stessa, la configurazione dell'altro non è la stessa. Queste sono tutte coppie diastereoisomeri , cioè. isomeri spaziali, Non costituendo antipodi ottici tra loro.
I diastereomeri differiscono l'uno dall'altro non solo nella rotazione ottica, ma anche in tutte le altre costanti fisiche: hanno diversi punti di fusione e di ebollizione, diverse solubilità, ecc. Le differenze nelle proprietà dei diastereomeri spesso non sono inferiori alle differenze nelle proprietà tra isomeri strutturali .
Un esempio di composto di questo tipo è l'acido cloromalico

Le sue forme stereoisomeriche hanno le seguenti formule di proiezione:

eritro- forme tre- forme
Titoli eritro- E trio- derivano dai nomi dei carboidrati eritrosio e treosio. Questi nomi sono usati per indicare la posizione relativa dei sostituenti nei composti con due atomi asimmetrici: eritro -isomeri sono quelli per cui nella formula di proiezione standard compaiono due sostituenti laterali identici su un lato (destro o sinistro); trio -isomeri hanno sostituenti laterali identici su lati diversi della formula di proiezione [NOTA 5].
Due eritro- gli isomeri sono una coppia di antipodi ottici; quando si mescolano si forma un racemo. Una coppia di isomeri ottici sono e tre- forme; producono anche un racemo quando mescolati, che differisce nelle proprietà dal racemo eritro- forme. Pertanto, ci sono un totale di quattro isomeri otticamente attivi dell'acido cloromalico e due racemati.
Con un ulteriore aumento del numero di centri asimmetrici, il numero di isomeri spaziali aumenta e ogni nuovo centro asimmetrico raddoppia il numero di isomeri. È determinato dalla formula 2 n, dove n è il numero di centri asimmetrici.
Il numero di stereoisomeri può diminuire a causa della simmetria parziale che appare in alcune strutture. Un esempio è l'acido tartarico, in cui il numero dei singoli stereoisomeri è ridotto a tre. Le loro formule di proiezione:

La formula I è identica alla formula Ia: si trasforma in essa ruotandola di 180° nel piano del disegno e, quindi, non rappresenta un nuovo stereoisomero. Questa è una modifica otticamente inattiva - forma meso . A differenza di un racemo, che può essere suddiviso in ottico antipodi, meso- la forma è fondamentalmente indistruttibile: ciascuna delle sue molecole ha un centro asimmetrico di una configurazione e il secondo - l'opposto. Di conseguenza, si verifica una compensazione intramolecolare della rotazione di entrambi i centri asimmetrici.
Meso- Tutte le sostanze otticamente attive hanno forme con diversi centri asimmetrici identici (cioè associati a sostituenti identici) [NOTA 6]. Formule di proiezione meso- le forme si riconoscono sempre dal fatto che possono sempre essere divise da una linea orizzontale in due metà, le quali, quando scritte su carta, sono formalmente identiche, ma in realtà sono speculari:

Le formule II e III raffigurano gli antipodi ottici dell'acido tartarico; quando vengono miscelati, si forma un racemato otticamente inattivo: l'acido dell'uva.
II.7. Nomenclatura degli isomeri ottici
Il sistema di nomenclatura degli antipodi ottici più semplice, più antico, ma ancora in uso si basa sul confronto della formula di proiezione dell'antipodo chiamato con la formula di proiezione di una certa sostanza standard scelta come “chiave”. Pertanto, per gli alfa idrossiacidi e gli alfa amminoacidi, la chiave è la parte superiore della loro formula di proiezione (in notazione standard):

L- idrossiacidi (X = OH) D- idrossiacidi (X = OH)
L-amminoacidi (X = NH 2) D- amminoacidi (X = NH 2)
La configurazione di tutti gli alfa-idrossiacidi che hanno un gruppo ossidrile a sinistra nella formula di proiezione di Fischer scritta standard è indicata dal segno l; se l'ossidrile si trova nella formula di proiezione a destra, segno - D[NOTA 7] .
La chiave per designare la configurazione degli zuccheri è la gliceraldeide:

L-(-)-gliceraldeide D-(+)-gliceraldeide
Nelle molecole di zucchero la designazione D- O L- si riferisce alla configurazione inferiore centro asimmetrico.
Sistema D-,L- la designazione presenta notevoli inconvenienti: in primo luogo, la designazione D- O L- indica la configurazione di un solo atomo asimmetrico; in secondo luogo, per alcuni composti si ottengono simboli diversi a seconda che si prenda come chiave la chiave gliceraldeide o idrossiacida, ad esempio:

Queste carenze del sistema chiave ne limitano attualmente l'uso a tre classi di sostanze otticamente attive: zuccheri, amminoacidi e idrossiacidi. Progettato per uso generale "Sistema R,S Kahn, Ingold e Prelog [NOTA 8].
Per determinare la configurazione R o S dell'antipodo ottico, è necessario disporre il tetraedro dei sostituenti attorno all'atomo di carbonio asimmetrico in modo tale che il sostituente più basso (solitamente idrogeno) abbia la direzione "lontano dall'osservatore". Quindi se si verifica il movimento durante la transizione in un cerchio dei tre sostituenti rimanenti dal più anziano al medio in anzianità e poi al più giovane Antiorario - Questo R -isomero (associato allo stesso movimento della mano quando si scrive la lettera R), se senso orario - Questo S- isomero (associato allo stesso movimento della mano quando si scrive la lettera S).
Per determinare l'anzianità dei sostituenti su un atomo asimmetrico, vengono utilizzate le regole per il calcolo dei numeri atomici, che abbiamo già considerato in relazione alla nomenclatura Z,E degli isomeri geometrici (vedi).
Per selezionare le notazioni R, S secondo la formula di proiezione, è necessario, mediante un numero pari di permutazioni (che, come sappiamo, non cambiano il significato stereochimico della formula), disporre i sostituenti in modo che il più giovane dei loro (solitamente idrogeno) si trovano in fondo alla formula di proiezione. Quindi l'anzianità dei restanti tre sostituenti, cadendo in senso orario, corrisponde alla designazione R, in senso antiorario - la designazione S [NOTA 9]:

Compiti di controllo
3. Determinare la configurazione del centro asimmetrico dell'acido ascorbico (vitamina C) (by R,S-nomenclatura e in confronto con la gliceraldeide):

4. L'alcaloide efedrina ha la formula:

Assegna un nome a questa connessione utilizzando R,S- nomenclatura.
5. La cisteina è un amminoacido non essenziale coinvolto nella regolazione dei processi metabolici l acido -1-ammino-2-mercaptopropionico. Disegna la sua formula strutturale e dagli il nome R,S- nomenclatura.
6. La levomicetina (antibiotico ad ampio spettro) lo è D(-)-treo-1-para-nitrofenil-2-dicloroacetilammino-propandiolo-1,3. Disegna la sua struttura sotto forma della formula di proiezione di Fischer.
7. Synestrol è un farmaco estrogeno sintetico con una struttura non steroidea. Dare il nome indicandone la configurazione stereochimica:

II.8. Stereochimica dei composti ciclici
Quando una catena di atomi di carbonio è chiusa in un ciclo planare, gli angoli di legame degli atomi di carbonio sono costretti a deviare dal loro normale valore tetraedrico e l'entità di questa deviazione dipende dal numero di atomi nel ciclo. Maggiore è l'angolo di deviazione dei legami di valenza, maggiore è la riserva energetica della molecola, meno stabile è il ciclo. Tuttavia, solo un idrocarburo ciclico a tre membri (ciclopropano) ha una struttura piatta; Partendo dal ciclobutano, le molecole di cicloalcano hanno una struttura non planare, che riduce la “tensione” nel sistema.
La molecola di cicloesano può esistere in diverse conformazioni in cui vengono mantenuti gli angoli di legame “normali” (per semplicità sono mostrati solo gli atomi di carbonio):

La conformazione energeticamente più favorevole è la conformazione I, la cosiddetta forma "poltrone". Conformazione II - "intrecciare" - occupa una posizione intermedia: è meno favorevole della conformazione a sedia (per la presenza in essa di atomi di idrogeno oscurati), ma più favorevole della conformazione III. Conformazione III - "bagno" - il meno favorevole dei tre a causa della significativa repulsione degli atomi di idrogeno diretti verso l'alto.
La considerazione dei dodici legami C-H nella conformazione a sedia permette di dividerli in due gruppi: sei assiale connessioni dirette alternativamente su e giù e sei equatoriale collegamenti diretti ai lati. Nei cicloesani monosostituiti, il sostituente può trovarsi in posizione equatoriale o assiale. Queste due conformazioni sono solitamente in equilibrio e passano rapidamente l'una nell'altra attraverso la conformazione di torsione:

La conformazione equatoriale (e) è solitamente più povera di energia e quindi più vantaggiosa rispetto alla conformazione assiale (a).
Quando negli anelli compaiono sostituenti (catene laterali), oltre al problema della conformazione dell’anello stesso, il ricercatore si trova ad affrontare anche problemi configurazioni sostituenti : quindi, nel caso della presenza di due sostituenti identici o diversi, cis-trans-isomero. Nota che parlare di cis-trans-la configurazione dei sostituenti ha senso solo se applicata ad anelli piccoli e medi saturi (fino a C 8): negli anelli con un gran numero di unità, la mobilità diventa così significativa che discussioni su cis- O trance- le posizioni dei deputati perdono il loro significato.
Pertanto, un classico esempio sono gli acidi ciclopropano-1,2-dicarbossilici stereoisomerici. Esistono due acidi stereoisomerici: uno di essi, avente p.f. 139 o C, è in grado di formare anidride ciclica ed è quindi cis-isomero. Un altro acido stereoisomerico p.f. 175 o C, non forma anidride ciclica; Questo trance-isomero [NOTA 10]:

Due acidi 1,2,2-trimetilciclopentan-1,3-dicarbossilici stereoisomerici sono nella stessa relazione tra loro. Uno di essi, l'acido canforico, p.f. 187 o C, forma un'anidride e, quindi, è cis-isomero. L'altro è acido isocanforico, p.f. 171 o C, - non forma anidride, questa trance-isomero:

cis-trans-
Sebbene la molecola di ciclopentano non sia effettivamente planare, per chiarezza è conveniente rappresentarla in forma piatta, come nella figura sopra, tenendo presente che in cis- l'isomero ha due sostituenti su un lato del ciclo , e dentro trance-isomero - sui lati opposti del ciclo .
I derivati del cicloesano disostituito possono esistere anche in forma cis o trans:
L'atomo di carbonio non ha il monopolio sulla creazione di centri chirali nelle molecole dei composti organici. Il centro della chiralità può anche essere silicio, stagno e atomi di azoto tetracovalente nei sali di ammonio quaternario e negli ossidi di ammine terziarie:

In questi composti il centro di asimmetria ha una configurazione tetraedrica, come l'atomo di carbonio asimmetrico. Esistono però anche composti con una diversa struttura spaziale del centro chirale.
I centri chirali formati da atomi di azoto trivalente, fosforo, arsenico, antimonio e zolfo hanno una configurazione piramidale. In linea di principio, il centro di asimmetria può essere considerato tetraedrico se la coppia elettronica solitaria dell'eteroatomo viene presa come quarto sostituente:

Può verificarsi anche attività ottica senza centro chirale, a causa della chiralità della struttura dell'intera molecola nel suo insieme ( chiralità molecolare O asimmetria molecolare ). Gli esempi più tipici sono la presenza asse chirale O piano chirale .
L'asse chirale appare, ad esempio, negli alleni contenenti vari sostituenti a sp2-atomi di carbonio ibridi. È facile vedere che i composti seguenti sono immagini speculari, e quindi antipodi ottici:

L'asse di chiralità è indicato nelle figure da una freccia.
Un'altra classe di composti aventi un asse chirale sono i bifenili otticamente attivi, che hanno orto-le posizioni hanno sostituenti voluminosi che ostacolano la libera rotazione attorno al legame C-C che collega gli anelli dell'arena:

Piano chirale caratterizzato dal fatto che si può distinguere tra lato “alto” e “basso”, nonché lato “destro” e “sinistro”. Un esempio di composti con un piano chirale è quello otticamente attivo trance- cicloottene e un derivato del ferrocene otticamente attivo.
L'isomeria configurazionale include l'isomeria ottica e geometrica.
ISOMERISMO OTTICO
Nel 1815 J. Biot scoprì l'esistenza dell'attività ottica per i composti organici. È stato scoperto che alcuni composti organici hanno la capacità di ruotare il piano di polarizzazione della luce polarizzata. Le sostanze che hanno questa capacità sono chiamate otticamente attive.
Se un raggio di luce ordinaria, in cui, come è noto, le oscillazioni elettromagnetiche si propagano in diversi piani perpendicolari alla direzione della sua propagazione, viene fatto passare attraverso un prisma di Nicol, la luce emergente sarà polarizzata nel piano. le oscillazioni elettromagnetiche si verificano solo su un piano. Questo piano è chiamato piano di polarizzazione (Fig. 3.2).
Quando un raggio di luce polarizzato attraversa una sostanza otticamente attiva, il piano di polarizzazione ruota di un certo angolo α verso destra o sinistra. Se una sostanza devia il piano di polarizzazione a destra (se osservata verso il raggio) si dice destrogira, se devia a sinistra è mancina. La rotazione a destra è indicata da un segno (+), la rotazione a sinistra da un segno (-).
Riso. 3.2. Schema della formazione della luce polarizzata e rotazione del piano di polarizzazione da parte di una sostanza otticamente attiva
L'attività ottica viene misurata utilizzando strumenti chiamati polarimetri.
Il fenomeno dell'attività ottica è comune tra le sostanze organiche, soprattutto tra quelle naturali (idrossi e aminoacidi, proteine, carboidrati, alcaloidi).
L'attività ottica della maggior parte dei composti organici è determinata dalla loro struttura.
Uno dei motivi per la comparsa dell'attività ottica nelle molecole organiche è la presenza nella loro struttura di un atomo di carbonio ibridato sp 3 associato a quattro diversi sostituenti. Un tale atomo di carbonio è chiamato chirale o asimmetrico. Spesso viene usato un nome più generale: centro chirale. Nelle formule strutturali, un atomo di carbonio asimmetrico è solitamente indicato con un asterisco – C*:

I composti contenenti un atomo di carbonio asimmetrico esistono sotto forma di due isomeri, legati tra loro come un oggetto alla sua immagine speculare. Tali isomeri sono chiamati enantiomeri.

Riso. 3.3. Modelli di molecole enantiomeriche di bromoclorometano
Le formule stereochimiche possono essere utilizzate per rappresentare la struttura spaziale degli isomeri ottici su un piano. Ad esempio, gli enantiomeri del 2-butanolo, rappresentati utilizzando formule stereochimiche, sono i seguenti:

Tuttavia, le formule stereochimiche non sono sempre convenienti per descrivere la struttura spaziale delle molecole. Pertanto, gli isomeri ottici sono spesso rappresentati su un piano utilizzando le formule di proiezione di Fischer. Ad esempio, questo è l'aspetto degli enantiomeri del 2-bromobutano, rappresentati utilizzando la proiezione di Fischer.

Gli enantiomeri sono molto simili tra loro, ma tuttavia non identici. Hanno la stessa composizione e sequenza di legami degli atomi nella molecola, ma differiscono l'uno dall'altro nella loro posizione relativa nello spazio, cioè nella configurazione. È facile vedere che queste molecole sono diverse quando si tenta di sovrapporre i loro modelli l'uno all'altro.
La proprietà delle molecole di non combinarsi con la loro immagine speculare è chiamata chiralità (dal greco cheir - mano), e le molecole sono anche chiamate chirali. Un chiaro esempio sono le mani sinistra e destra, che sono immagini speculari l'una dell'altra, ma allo stesso tempo non possono essere combinate. Le molecole compatibili con la loro immagine speculare sono chiamate achirali.
La chiralità delle molecole è un prerequisito affinché una sostanza possa esibire attività ottica.
Come determinare se una molecola è chirale? La chiralità di una molecola può essere facilmente rilevata costruendo un modello della molecola e un modello della sua immagine speculare e quindi combinandoli. Se i modelli non sono compatibili la molecola è chirale; se sono compatibili la molecola è achirale. La stessa conclusione si può trarre sulla base delle formule stereochimiche delle molecole basate sulla presenza e sull'assenza di elementi di simmetria, poiché la ragione dell'attività ottica dei composti organici è la loro struttura asimmetrica. Poiché la molecola è una formazione tridimensionale, la sua struttura può essere considerata dal punto di vista della simmetria delle figure geometriche. Gli elementi principali della simmetria sono il piano, il centro e l'asse di simmetria. Se una molecola non ha un piano di simmetria, allora tale molecola è chirale.
Gli enantiomeri hanno le stesse proprietà fisiche e chimiche (punto di ebollizione, punto di fusione, solubilità, conduttività elettrica e altre costanti saranno le stesse), ruotano il piano di polarizzazione del fascio polarizzato dello stesso angolo, ma ci sono anche differenze.
Gli enantiomeri differiscono nel segno di rotazione, uno ruota il piano di polarizzazione del fascio polarizzato verso sinistra, l'altro verso destra; reagiscono a velocità diverse con altri composti chirali e c'è anche una differenza nell'azione fisiologica. Ad esempio, il farmaco levomicina è un antibiotico ad ampio spettro. Se la sua efficienza è pari a 100, la forma destrogira sarà solo il 2% dell'efficienza della forma mancina.
Se una molecola ha un atomo asimmetrico, allora esiste sotto forma di due isomeri, ma se la molecola ha diversi atomi di carbonio asimmetrici, aumenta il numero di possibili isomeri. Il numero di isomeri ottici è determinato dalla formula:
dove N è il numero di isomeri; n è il numero di atomi di carbonio asimmetrici.
Quindi, se ci sono due atomi di carbonio asimmetrici in una molecola, il numero di isomeri è 2 2 = 4, tre – 2 3 = 8, quattro – 2 4 = 16, ecc.
Ad esempio, l'acido bromomalico, contenente due atomi di carbonio asimmetrici, esiste sotto forma di quattro stereoisomeri (I-IV).

Gli stereomeri I e II, così come III e IV, si relazionano tra loro come un oggetto e la sua immagine speculare e sono enantiomeri.
Gli stereoisomeri 1 e III, 1 e IV, così come II e HI, H e IV non sono immagini speculari l'uno dell'altro, differiscono nella configurazione in uno degli atomi di carbonio asimmetrici. Tali stereoisomeri sono chiamati diastereomeri. A differenza degli enantiomeri, i diastereomeri hanno proprietà fisiche e chimiche diverse.
Per i composti contenenti due atomi di carbonio chirali legati a sostituenti identici, il numero totale di stereoisomeri è ridotto a tre. Ad esempio, l'acido tartarico dovrebbe esistere sotto forma di quattro stereoisomeri (2 2 = 4), ma se ne conoscono solo tre. Ciò è dovuto alla comparsa di un elemento come un piano di simmetria in uno degli stereoisomeri.

Gli stereomeri 1 e II sono enantiomeri. Lo stereoisomero III (forma meso) è otticamente inattivo. La molecola dell'acido mesotartarico è achirale. Ciascun enantiomero dell'acido tartarico è un diastereomero relativo alla forma meso.
Nomenclatura degli isomeri ottici
Nella nomenclatura, insieme al nome del composto, sono indicate anche la configurazione e il senso di rotazione del piano della luce polarizzata. Quest'ultimo è indicato con un segno (+) per un isomero destrogiro o un segno (-) per un isomero levogiro.
Per indicare la configurazione degli isomeri ottici, ci sono D, L- e R,S-sistemi stereochimici.
Sistema di designazione della configurazione D,L. Stabilire la configurazione assoluta delle molecole si è rivelato un compito molto difficile per i chimici. Ciò fu ottenuto per la prima volta solo nel 1951 utilizzando l'analisi di diffrazione dei raggi X. Fino a quel momento la configurazione degli isomeri ottici veniva stabilita mediante il confronto con una sostanza standard appositamente selezionata. Questa configurazione è chiamata relativa. Nel 1906, lo scienziato russo M.A. Rozanov ha proposto la gliceraldeide come standard per stabilire la configurazione relativa,

Per l'isomero destrogiro abbiamo scelto la formula di Fischer, in cui il gruppo idrossile nell'atomo di carbonio chirale è a destra, e per l'isomero levogiro, a sinistra. La configurazione dell'isomero destrogiro è indicata dalla lettera D e l'isomero levogiro da L.
Utilizzando la gliceraldeide come standard di confronto, è stato sviluppato un sistema D,L per la classificazione stereochimica dei composti chirali, ovvero assegnando i composti rispettivamente alle serie stereochimiche D o L
Il sistema D,L è utilizzato principalmente nella gamma di alcoli polivalenti, idrossi-, amminoacidi e carboidrati:

Per i composti con più atomi di carbonio asimmetrici, come α-pirossiacidi, α-amminoacidi, acidi tartarici, la configurazione è convenzionalmente determinata dall'atomo di carbonio asimmetrico superiore (secondo la chiave dell'idrossiacido), mentre in una molecola di carboidrato la configurazione è determinato (convenzionalmente) dall'atomo di carbonio asimmetrico inferiore.

Sistema di designazione della configurazione R,S. D,L- il sistema si è rivelato praticamente inaccettabile per composti che hanno poca somiglianza con la gliceraldeide. Pertanto, R è stato proposto da Kahn, K. Ingold e V. Prelog R,S- sistema per designare la configurazione assoluta degli isomeri ottici. R,S- Il sistema si basa sulla determinazione dell'anzianità dei sostituenti nel centro chirale.
L'anzianità dei sostituenti è determinata dai numeri atomici degli elementi. Più alto è il numero atomico, più vecchio è il sostituente. Ad esempio, in una molecola di bromoiodoclorometano, l'anzianità dei sostituenti diminuisce nella serie:

Dopo aver stabilito l'anzianità dei sostituenti, la molecola modello viene orientata in modo che il sostituente con il numero atomico più basso sia diretto nella direzione opposta all'occhio dell'osservatore. Se l'anzianità dei tre sostituenti rimanenti diminuisce in senso orario, allora la molecola ha una configurazione denotata dalla lettera R (lat., retto - a destra), e se l'anzianità dei sostituenti diminuisce in senso antiorario, la configurazione è denotata dalla lettera S ( lat. sinistro - sinistra). Ad esempio, per una molecola di bromoiodoclorometano:

Figura 3.4. Determinazione della configurazione mediante il sistema R,S per la molecola di bromoiodoclorometano
Consideriamo la determinazione dell'anzianità dei sostituenti e della configurazione per molecole più complesse utilizzando l'esempio dell'acido lattico (Fig. 3.4). Già dal primo strato (8 O, b C, 1 H, 6 C) diventa chiaro che il sostituente senior è il gruppo OH e il sostituente junior è l'idrogeno. Per determinare l'anzianità degli altri due sostituenti CH^ e COOH con lo stesso numero atomico (6 C) nel primo strato è necessario considerare il secondo strato. La somma dei numeri atomici del secondo strato del gruppo CH 3 = 1 + 1 + 1 = 3 e del gruppo COOH = 8 + 8 * 2 = 24. Ciò significa che il gruppo COOH è più vecchio del gruppo –CH 3 L'anzianità dei sostituenti attorno all'atomo di carbonio asimmetrico nella molecola dell'acido lattico diminuisce nella serie: OH > COOH > CH 3 > H.


Riso. 3.5. Determinazione della configurazione utilizzando il sistema R,S per l'acido lattico
Racemati. Una miscela di uguali quantità di enantiomeri è otticamente inattiva e viene chiamata miscela racemica (racemato). I racemati differiscono dai singoli enantiomeri nelle proprietà fisiche possono avere punti di fusione e solubilità diversi; differiscono nelle caratteristiche spettrali.
In pratica, spesso non si incontrano singoli enantiomeri, ma racemi, che si formano a seguito di reazioni chimiche che si verificano con la formazione di molecole chirali.
Vengono utilizzati tre metodi per separare i racemi in enantiomeri:
1. Metodo meccanico. Come risultato della cristallizzazione di alcuni composti otticamente attivi, si possono formare due forme di cristalli, simili tra loro come oggetto e la sua immagine speculare. Possono essere separati al microscopio con un ago preparativo (meccanicamente).
2. Il metodo biochimico si basa sul fatto che alcuni tipi di microrganismi preferiscono una delle forme enantiomeriche e la mangiano, la seconda rimane e può essere facilmente isolata.
3. Metodo chimico Il metodo chimico si basa sulla conversione di enantiomeri utilizzando reagenti otticamente attivi in di-stereomeri, che già differiscono tra loro per proprietà fisiche. I diastereoisomeri sono molto più facili da separare.
Ad esempio, una miscela racemica di due acidi (A + B) deve essere separata. Per fare ciò, alla miscela viene aggiunta una base otticamente attiva (C). Avviene una reazione tra la forma racemica e la base otticamente attiva
AC e BC sono diastereoisomeri. Hanno solubilità diverse e mediante cristallizzazione sequenziale è possibile isolare separatamente due diastereomeri.
Ma poiché AC e BC sono formati da acidi e basi organici deboli, per decomporrli vengono utilizzati acidi minerali.

In questo modo si ottengono gli enantiomeri A e B puri.
ISOMERISMO GEOMETRICO
La ragione del verificarsi dell'isomeria geometrica è l'assenza di rotazione libera attorno al legame σ. Questo tipo di isomerismo è caratteristico dei composti contenenti un doppio legame e dei composti aliciclici.
Gli isomeri geometrici sono sostanze che hanno la stessa formula molecolare, la stessa sequenza di legami degli atomi nelle molecole, ma differiscono tra loro nella diversa disposizione degli atomi o dei gruppi atomici nello spazio rispetto al piano del doppio legame o al piano dell'anello.
La ragione del verificarsi di questo tipo di isomerismo è l'impossibilità di rotazione libera attorno al doppio legame o ai legami σ che formano il ciclo.
Ad esempio, butene-2 CH 3 –CH=CH–CH 3 può esistere sotto forma di 2 isomeri, che differiscono nella posizione dei gruppi metilici nello spazio rispetto al piano del doppio legame.

oppure 1,2-dimetilciclopropano esiste sotto forma di due isomeri, che differiscono nella disposizione dei gruppi metilici nello spazio rispetto al piano dell'anello:

Per designare la configurazione degli isomeri geometrici, viene utilizzato il sistema cis-, trans. Se sostituenti identici si trovano sullo stesso lato del piano del doppio legame o dell'anello, la configurazione è denominata cis-. se su lati opposti - trans-.
Per i composti che hanno sostituenti diversi negli atomi di carbonio con un doppio legame, viene utilizzato il sistema di notazione Z,E.
Il sistema Z,E è più generale. È applicabile agli isomeri geometrici con qualsiasi insieme di sostituenti. Questo sistema si basa sull'anzianità dei sostituenti, che è determinata separatamente per ciascun atomo di carbonio. Se i sostituenti senior di ciascuna coppia si trovano su un lato del doppio legame, la configurazione è indicata con la lettera Z (dal tedesco zusammen - insieme), se su lati opposti - con la lettera £ (dal tedesco entgegen - opposto).
Quindi per l'1-bromo-1-cloropropene sono possibili due isomeri:

Il sostituente senior su un atomo di carbonio è un gruppo metilico (sostituenti 1 H e 6 CH 3). e l'altro ha un atomo di bromo (sostituenti 17 Cl e 35 Br). Nell'isomero 1, i sostituenti senior sono posizionati su un lato del piano del doppio legame; gli viene assegnata una configurazione Z e all'isomero II viene assegnata una configurazione E (i sostituenti senior sono posizionati sui lati opposti del piano del doppio legame).
Gli isomeri geometrici hanno diverse proprietà fisiche (punti di fusione e di ebollizione, solubilità, ecc.), caratteristiche spettrali e proprietà chimiche. Questa differenza nelle proprietà rende abbastanza facile stabilire la loro configurazione utilizzando metodi fisici e chimici.
La ragione del verificarsi dell'isomeria geometrica è l'assenza di rotazione libera attorno al legame σ. Questo tipo di isomerismo è caratteristico dei composti contenenti un doppio legame e dei composti aliciclici.
Gli isomeri geometrici sono sostanze che hanno la stessa formula molecolare, la stessa sequenza di legami degli atomi nelle molecole, ma differiscono tra loro nella diversa disposizione degli atomi o dei gruppi atomici nello spazio rispetto al piano del doppio legame o al piano dell'anello.
La ragione del verificarsi di questo tipo di isomerismo è l'impossibilità di rotazione libera attorno al doppio legame o ai legami σ che formano il ciclo.
Ad esempio, butene-2 CH 3 -CH=CH-CH 3 può esistere sotto forma di due isomeri, che differiscono nella posizione dei gruppi metilici nello spazio rispetto al piano del doppio legame.
oppure 1,2-dimetilciclopropano esiste sotto forma di due isomeri, che differiscono nella disposizione dei gruppi metilici nello spazio rispetto al piano dell'anello:

Per designare la configurazione degli isomeri geometrici, viene utilizzato il sistema cis-, trans. Se sostituenti identici si trovano sullo stesso lato del piano del doppio legame o dell'anello, la configurazione è denominata cis-. se su lati opposti - trans-.
ISOMERISMO CONFORMAZIONALE
L'isomeria conformazionale (rotazionale) è causata dalla rotazione di atomi o gruppi atomici attorno a uno o più legami σ semplici. Come risultato della rotazione attorno ai legami C-C, le molecole possono avere diverse forme spaziali, chiamate conformazioni.
Ad esempio, una molecola di etano, a causa della rotazione attorno ad un legame carbonio-carbonio, può assumere un numero infinito di conformazioni. ognuno dei quali è caratterizzato da un certo valore di energia potenziale. Le due conformazioni estreme sono dette eclissate e inibite.

Nella conformazione eclissata dell'etano, gli atomi di idrogeno dei gruppi metilici, se visti lungo il legame carbonio-carbonio, si trovano uno dietro l'altro. Nello stato inibito, gli atomi di idrogeno di un gruppo metilico sono la massima distanza dagli atomi di idrogeno dell'altro. Tra le conformazioni eclissate e inibite, la molecola adotta molte conformazioni oblique durante la rotazione.
Ciascuna conformazione della molecola di etano è caratterizzata da una diversa energia potenziale. La conformazione eclissata ha la massima energia, mentre la conformazione inibita ha la minima.
La conformazione inibita, in cui i gruppi metilici (sostituenti voluminosi) sono il più distanti possibile l'uno dall'altro, è chiamata anti-conformazione. L'altra conformazione inibita è chiamata conformazione goffa.
La conformazione gauche inibita ha un'energia potenziale leggermente superiore (a causa dell'interazione metile-metile) rispetto all'anti-conformazione (non c'è alcuna interazione tra i metili).
Le conformazioni con la riserva energetica più bassa sono chiamate conformeri o isomeri conformazionali (rotazionali).
Pertanto, l'n-butano a 25 °C esiste per circa il 70% sotto forma di anticonforme e per il 30% come conformero goffo.
A differenza degli isomeri configurazionali, i conformeri si trasformano l'uno nell'altro senza rompere i legami chimici e non possono essere separati. Vengono rilevati solo con metodi fisico-chimici.
Durante la lezione avrai un'idea generale dei tipi di isomerismo e imparerai cos'è un isomero. Conoscere i tipi di isomerismo in chimica organica: strutturale e spaziale (stereoisomerismo). Utilizzando le formule strutturali delle sostanze, considerare i sottotipi di isomerismo strutturale (isomerismo scheletrico e posizionale), conoscere i tipi di isomerismo spaziale: geometrico e ottico.
Argomento: Introduzione alla chimica organica
Lezione: Isomeria. Tipi di isomeria. Isomeria strutturale, geometrica, ottica
1. Cos'è l'isomeria
I tipi di formule che descrivono le sostanze organiche che abbiamo esaminato in precedenza mostrano che a una formula molecolare possono corrispondere diverse formule strutturali.
Ad esempio, la formula molecolare C2H6O corrispondere due sostanze con diverse formule strutturali: alcol etilico e dimetil etere. Riso. 1.
L'alcol etilico è un liquido che reagisce con il sodio metallico liberando idrogeno e bolle a +78,5°C. Nelle stesse condizioni, il dimetiletere, un gas che non reagisce con il sodio, bolle a -230°C.
Queste sostanze differiscono nella loro struttura: sostanze diverse hanno la stessa formula molecolare.
Riso. 1. Isomeria interclasse
Il fenomeno dell'esistenza di sostanze che hanno la stessa composizione, ma strutture diverse e quindi proprietà diverse è chiamato isomeria (dalle parole greche “isos” - “uguale” e “meros” - “parte”, “parte”).
Tipi di isomeria
Esistono diversi tipi di isomeria.
2. Isomeria interclasse
L'isomeria strutturale è associata a diversi ordini di atomi in una molecola.
L'etanolo e il dimetiletere sono isomeri strutturali. Poiché appartengono a diverse classi di composti organici, questo tipo di isomerismo strutturale viene chiamato anche interclasse. Riso. 1.
3. Isomeria dello scheletro del carbonio
Gli isomeri strutturali possono esistere anche all'interno della stessa classe di composti, ad esempio la formula C5H12 corrisponde a tre diversi idrocarburi. Questo Isomeria dello scheletro di carbonio. Riso. 2.

Riso. 2 Esempi di sostanze - isomeri strutturali
4. Isomeria posizionale
Esistono isomeri strutturali con lo stesso scheletro di carbonio, che differiscono per la posizione di più legami (doppi e tripli) o di atomi che sostituiscono l'idrogeno. Questo tipo di isomeria strutturale è chiamato isomeria posizionale.
Riso. 3. Isomeria di posizione strutturale
5. Isomeria spaziale
Nelle molecole contenenti solo legami singoli, a temperatura ambiente è possibile una rotazione quasi libera dei frammenti molecolari attorno ai legami e, ad esempio, tutte le immagini delle formule dell'1,2-dicloroetano sono equivalenti. Riso. 4

Riso. 4. Posizione degli atomi di cloro attorno ad un singolo legame
Se la rotazione è ostacolata, ad esempio, in una molecola ciclica o con un doppio legame, allora isomeria geometrica o cis-trans. Negli isomeri cis, i sostituenti si trovano su un lato del piano dell'anello o del doppio legame, negli isomeri trans - sui lati opposti.
Gli isomeri cis-trans esistono quando sono legati ad un atomo di carbonio. due diversi vice Riso. 5.



Riso. 5. Isomeri cis e trans
6. Isomeria ottica
Un altro tipo di isomerismo nasce dal fatto che un atomo di carbonio con quattro legami singoli forma una struttura spaziale con i suoi sostituenti: un tetraedro. Se una molecola ha almeno un atomo di carbonio legato a quattro sostituenti diversi, isomeria ottica. Tali molecole non corrispondono alla loro immagine speculare. Questa proprietà si chiama chiralità - dal greco chier - "mano". Riso. 6. L'isomeria ottica è caratteristica di molte molecole che compongono gli organismi viventi.
|
|
|
Riso. 6. Esempi di isomeri ottici
Viene anche chiamato isomeria ottica enantiomerismo(dal greco enantios - "opposto" e meros - "parte"), e gli isomeri ottici lo sono enantiomeri. Gli enantiomeri sono otticamente attivi; ruotano il piano di polarizzazione della luce dello stesso angolo, ma in direzioni opposte: D-, o (+)-isomero, - a destra, io-, o (-)-isomero, - a sinistra. Una miscela di uguali quantità di enantiomeri, chiamata racemato, è otticamente inattiva ed è contrassegnata dal simbolo d, l- o (±).
Riassumendo la lezione
Durante la lezione hai ricevuto una comprensione generale dei tipi di isomerismo e di cosa sia un isomero. Abbiamo appreso i tipi di isomerismo in chimica organica: strutturale e spaziale (stereoisomerismo). Utilizzando le formule strutturali delle sostanze, abbiamo esaminato i sottotipi di isomerismo strutturale (isomerismo scheletrico e posizionale) e abbiamo conosciuto i tipi di isomerismo spaziale: geometrico e ottico.
Bibliografia
1. Rudzitis G. E. Chimica. Fondamenti di chimica generale. 10° grado: libro di testo per istituti di istruzione generale: livello base / G. E. Rudzitis, F. G. Feldman. - 14a edizione. - M.: Educazione, 2012.
2. Chimica. Grado 10. Livello del profilo: accademico. per l'istruzione generale istituzioni / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin, ecc. - M.: Bustard, 2008. - 463 p.
3. Chimica. Grado 11. Livello del profilo: accademico. per l'istruzione generale istituzioni / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin, ecc. - M.: Bustard, 2010. - 462 p.
4. Khomchenko G. P., Khomchenko I. G. Raccolta di problemi di chimica per i candidati alle università. - 4a ed. - M.: RIA "New Wave": Editore Umerenkov, 2012. - 278 p.
1. Interneturok. ru.
2. Chimica organica.
Compiti a casa
1. N. 1,2 (p. 39) Rudzitis G. E. Chimica. Fondamenti di chimica generale. 10° grado: libro di testo per istituti di istruzione generale: livello base / G. E. Rudzitis, F. G. Feldman. - 14a edizione. - M.: Educazione, 2012.
2. Perché il numero di isomeri negli idrocarburi della serie dell'etilene è maggiore di quello degli idrocarburi saturi?
3. Quali idrocarburi hanno isomeri spaziali?
Rafforzare il materiale con attrezzature sportive
Allenatore 1 Allenatore 2 Allenatore 3
Cis-trans-isomerismo O isomeria geometrica- uno dei tipi di stereoisomeria: consiste nella possibilità di posizionare sostituenti su uno o lati opposti del piano di un doppio legame o di un anello non aromatico. Tutti gli isomeri geometrici sono classificati come diastereomeri, poiché non sono immagini speculari l'uno dell'altro. Cis- E trance-gli isomeri si trovano sia tra i composti organici che inorganici. Concetti cis E trance non vengono utilizzati nel caso dei conformeri, due forme geometriche che si trasformano facilmente l'una nell'altra, e vengono invece utilizzate le denominazioni "syn" e "anti".
Designazioni " cis" E " trance" ha origine dal latino, tradotto da questa lingua cis significa "da un lato" e trance- “dall'altra parte” o “di fronte”. Il termine "isomerismo geometrico" secondo la IUPAC è considerato un sinonimo obsoleto cis-trance-isomerismo.
Dovrebbe essere ricordato cis-trans-la nomenclatura descrive parente disposizione dei sostituenti e non deve essere confuso con E,Z-nomenclatura che dà assoluto descrizione stereochimica e si applica solo agli alcheni.
Chimica organica
Cis-trans L'isomerismo è presente anche nei composti aliciclici, in cui i sostituenti possono trovarsi sullo stesso lato o su lati opposti del piano dell'anello. Un esempio è l'1,2-diclorocicloesano:
 |
  |
| trance-1,2-diclorocicloesano | cis-1,2-diclorocicloesano |
Differenza nelle proprietà fisiche
 |
 |
| cis-2-pentene | trance-2-pentene |
 |
 |
| cis-1,2-dicloroetilene | trance-1,2-dicloroetilene |
 |
 |
| cis-acido butenedioico (acido maleico) |
trance-acido butenedioico (acido fumarico) |
 |
 |
| Acido oleico | Acido elaidico |
Le differenze possono essere sottili, come nel caso del punto di ebollizione degli alcheni a catena lineare come il 2-pentene. cis-isomero del quale bolle a 37 °C, e trance-isomero - a 36 °C. Differenza fra cis- E trance- diventa ancora maggiore se la molecola ha legami polarizzati, come nell'1,2-dicloroetilene. Cis-l'isomero in questo caso bolle a 60,3 °C, ma trance-l'isomero bolle a 47,5 °C. Quando cis L'effetto isomero di due legami polari C-Cl si somma per formare un forte dipolo molecolare, che dà origine a forti interazioni intermolecolari (forze di Keeesome), che si aggiungono alle forze di dispersione e portano ad un aumento del punto di ebollizione. IN trance Nell’isomero -, invece, ciò non accade, poiché i due momenti dei legami C–Cl si trovano uno di fronte all’altro e si annullano a vicenda senza creare un momento dipolare aggiuntivo (sebbene il loro momento di quadrupolo non sia affatto nullo) .
I due isomeri geometrici dell'acido butenedioico sono così diversi nelle loro proprietà e reattività che hanno persino ricevuto nomi diversi: cis-l'isomero è chiamato acido maleico e trance-l'isomero è l'acido fumarico. La proprietà chiave che determina il punto di ebollizione relativo è la polarità della molecola, poiché migliora le interazioni intermolecolari, aumentando così il punto di ebollizione. Allo stesso modo, la simmetria determina il punto di fusione, poiché le molecole simmetriche si compattano meglio allo stato solido, anche se la polarità della molecola non cambia. Un esempio di tale relazione sono gli acidi oleico ed elaidico; Acido oleico, cis-isomero, ha un punto di fusione di 13,4 °C e diventa liquido a temperatura ambiente, mentre trance-l'isomero, l'acido elaidico, ha un punto di fusione più alto di 43 °C perché è più diretto trance-l'isomero ha un impaccamento più denso e rimane solido a temperatura ambiente.
Cis-trans-gli isomeri degli acidi dicarbossilici differiscono anche per l'acidità: acido maleico ( cis) è un acido molto più forte di quello fumarico ( trance). Pertanto, la prima costante di dissociazione per l'acido fumarico è pK a1= 3,03 e per l'acido maleico pK a1= 1,9. Al contrario, la costante di dissociazione del secondo gruppo carbossilico per l'acido fumarico è maggiore che per l'acido maleico e cioè: per l'acido fumarico pK a2= 4,44 e per l'acido maleico pK a2= 6,07. A causa della vicinanza spaziale dei gruppi carbossilici in cis-forma, la tendenza dell'idrogeno a ionizzarsi aumenta, quindi la prima costante dell'acido maleico risulta essere maggiore. Tuttavia, è più difficile per il secondo protone superare l'attrazione di due gruppi carbossilici vicini cis-isomero, quindi la seconda costante di dissociazione dell'acido maleico è inferiore a quella dell'acido fumarico. Un principio simile si applica agli acidi dicarbossilici aliciclici, tuttavia, all'aumentare della dimensione dell'anello, è necessario tenere conto anche dell'effetto della forma dell'anello non planare.
Costante di accoppiamento spin-spin nucleare vicinale (3 J HH), misurato utilizzando la spettroscopia NMR, più per trance-isomeri (intervallo: 12-18 Hz; media: 15 Hz) rispetto a cis-isomeri (intervallo: 0-12 Hz; media: 8 Hz).
Stabilità
Di norma per i sistemi aciclici trance cis. La ragione di ciò è solitamente l'aumento delle interazioni steriche indesiderate di sostituenti ravvicinati cis-isomero. Per lo stesso motivo, il calore specifico di combustione trance-gli isomeri sono inferiori a quelli cis, che indica una maggiore stabilità termodinamica. Le eccezioni a questa regola sono l'1,2-difluoroetilene, l'1,2-difluorodiazene (FN=NF), l'1-bromopropene-1 e molti altri etileni alogenati e ossigenati. In questo caso cis-l'isomero risulta essere più stabile di trance-isomero poiché tra tali sostituenti non predominano le forze repulsive, ma piuttosto le forze attrattive (come le forze di London). Inoltre, a causa del volume relativamente piccolo dei sostituenti, non si verificano ostacoli sterici. Degli 1,2-dialoetilene, solo l'1,2-diiodoetilene ha un isomero trans che è più stabile di cis-isomero, perché a causa dell'ampio raggio, gli atomi di iodio sperimentano una forte interazione spaziale se si trovano dallo stesso lato del doppio legame.
Interconversione di isomeri
Gli isomeri geometrici, la cui differenza è dovuta alla posizione dei sostituenti attorno al doppio legame, differiscono dalle forme stereoisomeriche di un altro tipo: i conformeri. Esistenza separata cis- E trance-gli isomeri sono essenzialmente possibili solo grazie all'elevata barriera energetica di rotazione attorno al doppio legame, che rende possibile l'esistenza separata cis- E trance-isomeri, mentre i conformeri esistono solo come miscela di equilibrio. La barriera alla rotazione attorno al doppio legame negli alcheni semplici è 250-270 kJ/mol. Tuttavia, se poniamo da un lato forti donatori di elettroni (-SR) e dall’altro gruppi forti accettori di elettroni (-CN, -COC 6 H 5), polarizzando così il doppio legame, ciò porterà ad una significativa riduzione del barriera di rotazione. La barriera alla rotazione attorno ad un legame così polarizzato può essere ridotta a 60-100 kJ/mol. Barriere a bassa energia quando la differenza di energia tra cis-trans-gli isomeri e i conformeri vengono levigati, trovati per i derivati amminici dell'estere acetoacetico e degli enammina chetoni. È stato dimostrato che in tali sistemi la posizione di equilibrio dipende dalla natura del solvente. Pertanto, gli enammina chetoni nei solventi non polari esistono al 100%. cis-forma stabilizzata mediante legami idrogeno interni e appare nei solventi polari fino al 50% trance-forme.
E,Z-nomenclatura
Sistema di notazione cis-tranceè utile solo per nominare alcheni isomerici con due diversi tipi di sostituenti sul doppio legame in molecole complesse tale nomenclatura diventa troppo vaga; In questi casi, utilizzare la IUPAC sviluppata E,Z- un sistema di notazione che definisce univocamente il nome dei composti per tutti i casi possibili, e quindi è particolarmente utile per nominare alcheni tri- e tetrasostituiti. Questo sistema evita confusione riguardo a quali gruppi dovrebbero essere considerati cis- O trance- in relazione tra loro.
Se due gruppi superiori si trovano dallo stesso lato del doppio legame, allora sono dentro cis-posizione l'uno rispetto all'altro, allora viene chiamata tale sostanza Z-isomero (dal tedesco zusammen - insieme). Quando i gruppi senior si trovano sui lati opposti del doppio legame (in trance-orientamento), allora viene chiamato tale isomero E-isomero (dal tedesco entgegen - opposto). L'ordine di precedenza dei gruppi e degli atomi è determinato dalle regole di Cahn-Ingold-Prelog. Per ciascuno dei due atomi del doppio legame è necessario determinare l'anzianità di ciascun sostituente. Se entrambi i sostituenti senior si trovano sullo stesso lato del piano del legame π, allora questa configurazione è denotata dal simbolo Z, se questi gruppi si trovano su lati diversi del piano di legame π, la configurazione è denotata dal simbolo E .
Si dovrebbe notare che cis/trance E E,Z-le nomenclature si basano sul confronto di diversi sostituenti alchenici, quindi Z-l'isomero non sempre corrisponde cis-isomero e E-isomero - trance-isomero. Per esempio, trance-2-clorobutene-2 (due gruppi metilici C1 e C4, sulla catena principale del butene-2a sono in trance-orientamento) è ( Z)-2-clorobutene-2 (il cloro è più vecchio del metile, che a sua volta è più vecchio dell'idrogeno, quindi il cloro e il C4-metile sono considerati situati insieme).
Nella chimica inorganica
Cis–trance-l'isomerismo si verifica anche nei composti inorganici, principalmente nei diazeni e nei composti complessi.
Diazeni
Presentano diazeni (e difosfeni simili). cis-trans- isomeria. Come nel caso dei composti organici, cis-l'isomero è più reattivo, solo che è in grado di ridurre gli alcheni e gli alchini in alcani. Trance-l'isomero, avvicinandosi a un alchene, non può allineare i suoi atomi di idrogeno per un'efficace riduzione dell'alchene, e cis L'isomero - grazie alla sua forma appropriata affronta con successo questo compito.
  |
  |
| trance-diazene | cis-diazene |
Connessioni complesse
Vengono classificati anche i composti di coordinazione inorganici con geometria ottaedrica o quadrata planare cis-isomeri in cui si trovano ligandi identici nelle vicinanze, e trance-isomeri in cui i ligandi sono distanziati.
Ad esempio, esistono due isomeri quadrati planari geometrici per Pt(NH 3) 2 Cl 2, un fenomeno spiegato da Alfred Werner nel 1893. Cis-isomero con nome completo cis-Il diclorodiamminoplatino(II) possiede attività antitumorale, come dimostrato da Barnett Rosenberg nel 1969. Ora questa sostanza è conosciuta in chemioterapia con il nome abbreviato cisplatino. Trance-l'isomero (transplatino), invece, non ha alcuna attività medicinale. Ciascuno di questi isomeri può essere sintetizzato sfruttando l'effetto trans, che consente di ottenere preferenzialmente l'isomero desiderato.
 |
 |
|
cis- + e trance- + |
||
Per i complessi ottaedrici con la formula MX 4 Y 2, ci sono anche due isomeri. (Qui M è l'atomo di metallo e X e Y sono ligandi di diverso tipo.) B cis-isomero, i due ligandi Y sono adiacenti tra loro con un angolo di 90°, come mostrato per gli atomi di cloro in cis- + nell'immagine a sinistra. IN trance Nell'isomero mostrato a destra, i due atomi di cloro si trovano alle estremità opposte della diagonale che passa attraverso l'atomo centrale di cobalto.
Un tipo simile di isomerismo dei complessi ottaedrici con la composizione MX 3 Y 3 è gran-os-isomerismo, o isomeria faccia-assiale, quando si ritrovano in esso un certo numero di ligandi cis- O trance-posizione l'uno rispetto all'altro. IN nonna-isomeri, leganti dello stesso tipo occupano i vertici della faccia triangolare dell'ottaedro, e in sistema operativo-isomeri, gli stessi ligandi sono in tre posizioni adiacenti in modo che i due ligandi siano sui lati opposti dell'atomo centrale e sullo stesso asse con esso