Плода, задержка в развитии или какая-нибудь иная патология беременности .
Плацента представляет собой орган, который образуется в месте имплантации плодного яйца к эндометрию матки , и который растет вместе с плодом на протяжении всей беременности. Плацента выполняет важную функцию по снабжению плода кислородом и питательными веществами. Происходит это, благодаря циркуляции крови по сосудам пуповины , которые тянутся от плаценты к телу плода. С другой стороны плаценты находятся кровеносные сосуды матки, которые и приносят все необходимые вещества.
В результате, через плаценту происходит передача питательных веществ плоду. Однако следует понимать, что кровь матери фильтруются через плаценту, но не смешивается с кровью ребенка.
Плацента выполняет следующие функции:
- обогащает кровь плода кислородом;
- убирает углекислый газ из крови плода;
- обогащает кровь плода питательными веществами;
- убирает продукты распада из крови плода.
Здоровая плацента растет в течение всей беременности, для того чтобы обеспечивать возрастающие потребности плода. К моменту родов ее вес составляет около 600 грамм. Если по каким-либо причинам происходит замедление роста плаценты, уменьшается объем притекающей к ней крови либо уменьшается площадь соприкосновения с маткой (как при преждевременной отслойке плаценты ), то возникает плацентарная недостаточность.
Плацентарная недостаточность развивается, когда плацента перестает справляться со своей функцией и развивается состояние недостатка кислорода и питательных веществ. В большинстве случаев данная патология возникает из-за нарушений кровотока, которые могут быть спровоцированы материнскими болезнями крови и сосудов.
Причинами плацентарной недостаточности могут быть:
- артериальная гипертензия (повышенное артериальное давление );
- некоторые лекарственные средства;
- употребление наркотических веществ (в особенности кокаин, героин, метамфетамин ).
Плацентарная недостаточность является патологией, которая несет основную опасность для плода. Однако в некоторых случаях данный недуг может угрожать и жизни матери.
Плацентарная недостаточность опасна для матери в следующих случаях:
- Артериальная гипертензия. Повышенное артериальное давление, на фоне которого развилась плацентарная недостаточность, является состоянием, которое может угрожать жизни матери. На фоне повышенного артериального давления может возникнуть кровоизлияние в головной мозг , разрыв сосудов и множество других опасных последствий.
- Преэклампсия. Преэклампсия является патологическим состоянием, которое предшествует эклампсии, и которое является одной из форм позднего токсикоза беременности. При данной патологии повышается артериальное давление, развиваются периферические отеки , в моче появляется избыток протеинов . Без лечения данное состояние может перейти в эклампсию, которая сопровождается судорогами , и которая лечится только путем устранения беременности.
- Преждевременная отслойка нормально расположенной плаценты. Плацента должна отслаиваться от стенки матки только после рождения плода. Если это происходит до родов, возникает состояние, известное как преждевременная отслойка нормально расположенной плаценты. При этом обычно возникает массивное маточное кровотечение , которое угрожает жизни матери и плода.
Плацентарная недостаточность может стать причиной следующих патологий беременности:
- внутриутробная смерть плода;
- кислородное голодание во время рождения (может стать причиной поражения центральной нервной системы );
- внутриутробная задержка развития (в тяжелых случаях – до 90% от нормы );
- гипотермия (низкая температура тела );
- гипогликемия (низкое содержание сахара в крови );
- гипокальциемия (низкое содержание кальция в крови );
- полицитемия (избыток красных кровяных телец, в результате чего кровь становится более вязкой );
- преждевременные роды;
- необходимость в кесаревом сечении .
Плацентарная недостаточность может стать причиной поражения следующих органов:
- головной мозг;
- желудочно-кишечный тракт.
Плацентарная недостаточность может быть выявлена следующими способами:
- ультразвуковое исследование (УЗИ ) и замер размеров плаценты и плода;
- ультразвуковое исследование и допплерометрия плацентарного кровотока;
- измерение уровня альфа-фетопротеина в крови матери;
- мониторинг состояния плода.
Беременность - естественное состояние женщины, но ее нормальное течение осуществляется сложными механизмами, которые направлены на обеспечение плода всем жизненно необходимым. В этом участвуют две функциональные системы – мать и плацента. Если есть, хотя бы, один малейший сбой в работе этих взаимосвязанных систем, то могут возникнуть два патологических состояния – маточно-плацентарная и фетоплацентарная недостаточность. Это абсолютно разные процессы, другое дело, что они ведут к одному и тому же – к нарушению кровообращения и питания в системе мать-плацента-плод. В этой статье речь пойдет о маточно-плацентарной недостаточности.
1. Что такое маточно-плацентарная недостаточность при беременности
Это плохое кровообращение в системе мать-плод из-за плохо сформировавшейся в плаценте сосудистой системы.
Связь плода и матери осуществляется только благодаря плаценте. Она начинает формироваться и развиваться с первых дней беременности, но ее нельзя считать самостоятельным органом. Однако роль плаценты огромна, ведь плод через нее получает кислород и различные питательные вещества. Она осуществляет роль мембраны, и фильтрует, не допуская поступление в организм не рожденного ребенка многих химических веществ. В течение всей беременности плацента играет роль эндокринного органа, она вырабатывает ряд важнейших гормонов и веществ, необходимых для сохранения и нормального ее протекания: прогестерон, эстроген, хорионический гонадотропин, и др. Нарушение функции плаценты, очень не благоприятно сказывается на течении беременности и развитие плода.
2. Факторы риска
Маточно-плацентарная недостаточность имеет свои причины:
Осложнение течения беременности: длительный и плохо поддающийся лечению токсикоз, угроза прерывания, перенашивание, несовместимости крови матери и плода по группе или резусу, внутриутробное инфицирование плода, многоплодная беременность и др.
Любые хронические заболевания матери: сахарный диабет, пороки сердца (врожденные или приобретенные), артериальная гипертензия, пиелонефрит, тонзиллит, анемия, аутоиммунные заболевания, опухоли любой локализации, в том числе и доброкачественные и др.
Возраст матери старше 35 лет и младше 17 лет.
Плохие бытовые условия.
Факторы внешней среды: радиационное и химическое воздействие.
Вредные привычки: курение, злоупотребление алкоголем и наркотиками.
Любые острые инфекционные заболевания: ОРВИ, гепатиты и др.
Гинекологические заболевания матери: кольпиты, аднексит, миома, фиброма, нарушение менструальной функции и др.
Плохой акушерский анамнез: рубец на теле матки, привычное не вынашивание, самопроизвольные выкидыши, частые аборты, мертворождение, осложненное течение предыдущих родов и беременности и др.
3. Течение маточно-плацентарной недостаточности
Первичная недостаточность развивается на ранних сроках беременности до 12-14 недель, бывает редко. Она возникает из-за плохого прикрепления плаценты к стенке матки. При данной патологии очень быстро нарушается питание эмбриона и беременность, как правило, заканчивается самопроизвольным выкидышем либо развитием грубых врожденных аномалий у плода.
Вторичная недостаточность развивается после 16 недель беременности и бывает чаще. При данном состоянии, как правило, возникает угроза выкидыша, и женщина попадает в отделение патологии.
4. Недостаточность маточно-плацентарного кровотока бывает: острая и хроническая
Острая недостаточность – следствие внезапно возникших нарушений кровообращения, в результате может произойти отслойка плаценты, что часто приводит к внутриутробной гибели плода и прерыванию беременности.
Хроническая недостаточность самое часто встречающееся нарушение маточно-плацентарного кровообращения, в результате функция плаценты нарушается, плод не получает всего необходимого, а сама она преждевременно стареет.
Диагностика недостаточности маточно-плацентарного кровообращения при беременности возможна только при помощи доплерографии (исследовании сосудов). И чем раньше проведено исследовании, тем лучше. В случае наличия изменений доктор назначит лечение и можно будет избежать многих неприятностей. Поэтому всегда нужно выполнять все назначения врача и во время становиться на учет в женской консультации.
ЛЕКЦИЯ 4 ПЛАЦЕНТАРНАЯ НЕДОСТАТОЧНОСТЬ И СИНДРОМ ВНУТРИУТРОБНОЙ ЗАДЕРЖКИ РОСТА ПЛОДАЛЕКЦИЯ 4 ПЛАЦЕНТАРНАЯ НЕДОСТАТОЧНОСТЬ И СИНДРОМ ВНУТРИУТРОБНОЙ ЗАДЕРЖКИ РОСТА ПЛОДА
Плацентарная недостаточность (ПН) - клинический синдром, обусловленный морфофункциональными изменениями в плаценте и нарушениями компенсаторно-приспособительных механизмов, обеспечивающих нормальный рост и развитие плода, а также адаптацию организма женщины к беременности. Плацентарная недостаточность представляет собой результат сложной реакции плода и плаценты на различные патологические состояния материнского организма и проявляется в комплексе нарушений транспортной, трофической, эндокринной и метаболической функций плаценты, лежащих в основе патологии плода и новорожденного. Клиническими проявлениями ее являются синдром задержки роста плода и/или гипоксия плода. Синдром задержки роста плода (СЗРП); внутриматочная задержка роста плода (ВЗРП); плод, малый для срока беременности и плод с малой массой при рождении - термины, описывающие плод, не достигший своего ростового потенциала вследствие генетических или средовых факторов. Общепринятым критерием является снижение веса менее 10%о для срока беременности (табл. 12).
МКБ-10
P00 - поражения плода и новорожденного, обусловленные состоянием матери, не связанным с настоящей беременностью;
P01 - поражения плода и новорожденного, обусловленные осложнениями беременности у матери;
P02 - поражения плода и новорожденного, обусловленные осложнениями со стороны плаценты, пуповины и плодных оболочек;
P05 - замедленный рост и недостаточность питания плода;
P20 - внутриутробная гипоксия.
Плацентарная недостаточность одинаково часто отмечается при акушерской и экстрагенитальной патологии у беременных и составляет 22,4-30,6%. Так, при угрозе прерывания беременности ПН диагностируется более чем у 85% женщин, при гестозе - у 30,3%, при артериальной гипертонии - у 45%, при анемии и изосерологической несовместимости крови матери и плода - до 32,2%, при миоме матки -
Таблица 12. 10%о массы при рождении (г) в зависимости от пола новорожденного при одноплодной беременности
Гестационный возраст, нед | Мальчики | Девочки |
у 46%, при сахарном диабете - у 55%, при нарушениях жирового обмена - у 24% беременных. Перинатальная смертность при ПН достигает 40%, перинатальная заболеваемость - 738-802%о. На долю гипоксически-ишемического поражения ЦНС приходится 49,9%, что в 4,8 раза выше, чем при неосложненной беременности, дыхательные нарушения и аспирационный синдром отмечаются у 11% новорожденных, а реанимационные мероприятия необходимо проводить
15,2% детей. Встречаемость СЗРП варьирует в популяции от 10 до 23% доношенных новорожденных в развитых и развивающихся странах соответственно. Частота СЗРП возрастает с уменьшением срока беременности. Наличие врожденных пороков развития, внутриутробной гипоксии, транзиторных кардиореспираторных нарушений, хромосомных аберраций, внутриутробных инфекций, а также недоношенность значительно (до 60%) увеличивают риск перинатальных потерь.
Перинатальная смертность среди таких новорожденных значительно выше таковой среди новорожденных с соответствующей сроку массой (табл. 13).
Таблица 13. Перинатальная смертность при СЗРП (на 1000)
Вес, г | 37-38 нед | 39-40 нед | 41-42 нед |
Так, среди доношенных новорожденных массой 1500-2500 г перинатальная смертность в 5-30 раз выше, массой менее чем 1500 г - в 70-100 раз выше, чем у новорожденных с нормальной для срока массой тела (рис. 19).
70% плодов и новорожденных, чей вес не выше 10% для срока беременности, малы вследствие конституциональных факторов (женский пол, принадлежность матери к определенным этническим группам, паритет родов, массо-ростовые особенности матери), однако среди данных детей показатели перинатальной смертности не отличаются от таковых у детей с нормальной для срока массой. Среднетяжелая и тяжелая задержка роста определяется массой от 3 до 10% и менее 3% соответственно.
Классификация. Общепринятой классификации ПН в связи с ее мультифакториальной этиологией не существует. В зависимости от того, в каких структурных единицах возникают патологические процессы, различают три формы плацентарной недостаточности:
Гемодинамическую, проявляющуюся в маточно-плацентарном и плодово-плацентарном бассейнах;
Рис. 19. Показатели перинатальной заболеваемости и смертности среди плодов и новорожденных с малой массой тела
Плацентарно-мембранную, характеризующуюся снижением способности плацентарной мембраны к транспорту метаболитов;
Клеточно-паренхиматозную, связанную с нарушением клеточной активности трофобласта и плаценты.
Выделяют также первичную плацентарную недостаточность, возникшую до 16 нед беременности, и вторичную, развивающуюся в более поздние сроки. Первичная недостаточность плаценты возникает в период имплантации, раннего эмбриогенеза и плацентации под влиянием разнообразных факторов (генетические, эндокринные, инфекционные и т.д.), действующих на гаметы родителей, зиготу, бластоцисту, формирующуюся плаценту и половой аппарат женщины в целом. Первичная фетоплацентарная недостаточность проявляется анатомическими изменениями строения, расположения и прикрепления плаценты, а также дефектами васкуляризации и нарушениями созревания хориона. Кроме того, при данной форме фетоплацентарной недостаточности чаще, чем в популяции выявляются пороки развития плода, хромосомные аномалии и внутриутробное инфицирование.
Вторичная фетоплацентарная недостаточность развивается под влиянием экзогенных факторов и наблюдается во второй половине беременности.
Плацентарная недостаточность (первичная и вторичная) имеет острое или хроническое течение. Острая ПН возникает как следствие обширных инфарктов плаценты и преждевременной отслойки нормально расположенной плаценты с образованием ретроплацентарной гематомы, в результате чего наступает гибель плода. Хроническая ПН наблюдается у каждой третьей беременной группы высокого риска перинатальной патологии. Хроническая ПН развивается рано и протекает длительно, вследствие нарушения компенсаторно-приспособительных механизмов в сочетании с циркуляторными расстройствами, инволютивно-дистрофическими изменениями и воспалением или обострением, связанными с заболеванием женщины во время беременности.
В настоящее время более целесообразно выделять декомпенсированную, субкомпенсированную и компенсированную формы. Данная классификация основана на степени отставания роста плода, наличии и выраженности признаков хронической внутриутробной гипоксии плода, степени гемодинамических нарушений в системе мать-плацента-плод, выраженности нарушений гормональной функции плаценты, эффективности проводимого лечения.
Процесс роста плода состоит из трех последовательных фаз. Первая фаза - фаза клеточной гиперплазии занимает первые 16 нед беременности. Вторая фаза - фаза одновременной гиперплазии и гипертрофии, представляющая собой одновременное возрастание числа клеток и увеличение их размера, занимает период времени между 16 и 32-й нед. Третья фаза - клеточной гипертрофии, продолжается с 32-й нед до родов и характеризуется быстрым увеличением размера клеток. При количественной оценке темпов роста плода установлено, что увеличение массы плода при одноплодной беременности на 5 г/сут отмечается в 14-15 нед, 10 г/сут - в 20 нед, 30- 35 г/сут - в 32-34 нед. В последующем темпы прироста массы тела снижаются. Классификация синдрома задержки роста плода возможна только при проведении расширенной ультразвуковой фетометрии при динамическом обследовании беременной. По форме выделяют: симметричную - при равномерном отставании всех фетометрических показателей (20-30% от всех наблюдений; асимметричную - преимущественное уменьшение размеров живота плода (70-80%) и
смешанную - уменьшение всех фетометрических показателей при преимущественном снижении размеров (окружности) живота плода (5-10%). По степени тяжести в антенатальном периоде выделяют I степень - отставание фетометрических параметров на 1-2 нед от должных для срока гестации, II степень - отставание на 2-4 нед, III степень - отставание более чем на 4 нед.
Этиология и патогенез. Развитие плацентарной недостаточности и СЗРП зависит от нарушений в самой плаценте, наличия соматической или акушерской патологии у матери, а также от состояния плода. Реакция системы мать-плацента-плод зависит от каждого из участников патологического процесса и степени нарушений их компенсаторно-приспособительных механизмов. ПН и СЗРП возникают у беременных группы высокого риска по развитию различных осложнений гестации.
S. Moddley (1997) выделяет 3 основные группы причин СЗРП: материнские, маточно-плацентарные, плодовые:
1. Материнские:
Демографические: возраст, социально-экономический статус, расово-этнические особенности;
Конституциональные: генетические особенности, рост, масса при рождении, масса пациентки перед беременностью;
Заболевания: гипертензия, аутоиммунные болезни, анемия, хронические сердечно-легочные заболевания, хронические заболевания почек, диабет с сосудистыми изменениями;
Тромбофилические нарушения и гиперкоагуляция у матери;
Аутоиммунные нарушения матери, в том числе антифосфилипидный синдром;
Неадекватное питание;
Другие: курение, алкоголь, лекарственные средства.
2. Маточно-плацентарные:
Инфаркты плаценты;
Плацентарный мозиацизм;
Аномалии матки;
Многоплодная беременность.
3. Плодовые:
Конституциональные: генетические особенности, пол, положение;
Анеуплоидия/наследственные синдромы;
Внутриутробные инфекции;
Аномалии плода: врожденные пороки сердечно-сосудистой системы, единственная артерия пуповины, фето-фетальный трансфузионный синдром. По А.Т. Бунину (1993) факторами риска, способствующими развитию плацентарной недостаточности и СЗРП, являются:
Социально-бытовые (возраст менее 17 и более 30 лет, беременность вне брака, профессиональные вредности, тяжелый физический труд, эмоциональное перенапряжение, курение, алкоголизм, наркомания, масса тела менее 50 кг);
Соматические (хронические специфические и неспецифические инфекции, экстрагенитальные заболевания);
Акушерско-гинекологические (инфантилизм, нарушение менструальной функции, первичное бесплодие, гинекологические заболевания, самопроизвольное прерывание беременности, неразвивающаяся беременность, осложненное течение предшествующей беременности и родов);
Факторы, связанные с настоящей беременностью (токсикозы первой и второй половины, угроза прерывания беременности, многоплодная беременность).
Среди причин возникновения ПН и СЗРП ведущее место занимают осложнения беременности (гестоз, угроза прерывания беременности, перенашивание, изосерологическая несовместимость крови матери и плода, многоплодная беременность) и экстрагенитальная патология (дисфункция коры надпочечников, гипертоническая болезнь, хронический пиелонефрит, гломерулонефрит, сахарный диабет, тиреотоксикоз, сердечно-сосудистые и гематологические заболевания матери).
В начале I триместра беременности у пациенток группы высокого риска развития фетоплацентарной недостаточности происходит неполноценная инвазия трофобласта в миометральный сегмент спиральных артерий. Первичным звеном гемодинамических нарушений при СЗРП являются изменения маточно-плацентарного кровообращения (МПК), морфологическую основу которых составляет отсутствие физиологических гестационных изменений спиральных артерий и их спазм, а также поражение сосудистой стенки при аутоиммунных процессах.
Вследствие патологических изменений в спиральных артериях миометрия, обеспечивающих нормальное функционирование маточно-плацентарной циркуляции, происходит нарушение крово-
обращения в межворсинчатом пространстве. Замедление кровотока в спиральных артериях и межворсинчатом пространстве неизменно приводит к снижению газообмена между кровью матери и плода. В результате происходящих нарушений циркуляции крови в системе МПК развиваются ишемические инфаркты плаценты, в которые вовлекаются целые котиледоны. Естественно, что на этом фоне существенно поражается и капиллярный кровоток в ворсинах хориона.
Одной из важных причин расстройства функции плаценты и развития ПН является незрелость ворсинчатого дерева, которая проявляется изменениями всех ее структурных единиц. Действие повреждающих факторов, способствующих развитию плацентарной недостаточности, снижают компенсаторно-приспособительные реакции в системе мать-плацента-плод.
Ведущая роль тех или иных патогенетических механизмов в развитии ПН во многом обусловлена ее этиологическими факторами. В результате действия повреждающих факторов в I-II триместре (инфекции, интоксикации) развитие ПН обусловлено в основном преобладающим поражением плацентарного барьера, при этом наблюдаются наиболее тяжелые варианты незрелости ворсин с прогрессирующим склерозом стромы. Отмечается выраженное снижение плодового и внутриплацентарного кровотока (в капиллярном русле плаценты) при относительной сохранности маточно-плацентарного, что приводит к развитию гипоксии плода. На ранних сроках гестации (до 20-22 нед) при недостаточно развитых механизмах ауторегуляции плода (абсолютное уменьшение числа клеток в гиперпластическую фазу клеточного роста) формируется симметричная форма СЗРП. Для данной формы синдрома характерно уменьшение всех фетометрических показателей, отражающих рост плода (бипариетальный размер, окружность головки плода, окружность и диаметр живота, размер длинных трубчатых костей, в том числе бедренной). Следует отметить, что частота СЗРП при пороках развития составляет 19,5%. С другой стороны, врожденные пороки развития при СЗРП наблюдаются в 7-15%. Асимметричная форма СЗРП в структуре врожденных пороков развития составляет 30,6%, тогда как симметричная - 69,4%.
Во второй половине беременности ведущим патогенетическим звеном ПН является нарушение маточно-плацентарного кровотока, которое приводит к хронической внутриутробной гипоксии плода и формированию СЗРП. На фоне хронической внутриутробной гипок-
сии происходит перераспределение плодового кровотока, направленное в первую очередь на нормальное функционирование ЦНС. Основной поток артериальной крови направляется к головному мозгу плода («brain-sparing effect»). Клинически формируется асимметричная форма задержки роста плода, для которой характерно преимущественное уменьшение окружности живота плода. Выделяют еще так называемую смешанную форму синдрома задержки роста плода, наблюдаемую при тяжелой синдромной патологии плода либо при тяжелой экстагенитальной патологии женщины, сопровождающейся осложненным течением беременности (гестоз, длительная угроза прерывания). Для указанной формы характерно уменьшение всех фетометрических параметров по данным УЗИ с преимущественным уменьшением размеров живота за счет выраженного недоразвития подкожно-жировой клетчатки и объема паренхиматозных органов плода. Наблюдаемые изменения связаны как с нарушением процессов клеточного роста (синдромная патология плода), так и выраженными, длительно существующими гемодинамическими нарушениями в системе мать-плацента-плод (экстрагенитальная патология матери, длительно текущий гестоз, угроза прерывания беременности).
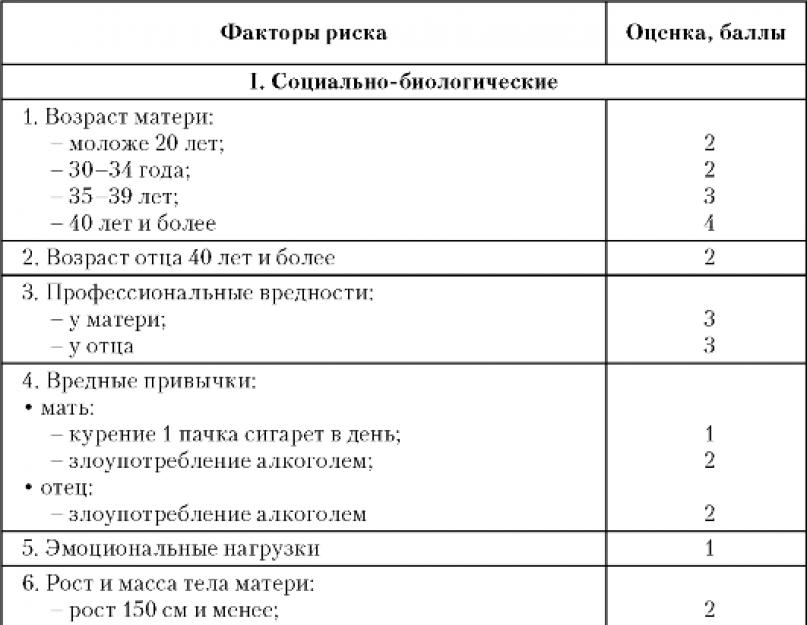
Диагностика. В настоящее время применяют различные методы диагностики плацентарной недостаточности. К клиническим методам относятся выявления анамнестических факторов риска, объективное обследование беременной и плода путем измерения окружности живота и высоты стояния дна матки, определения тонуса миометрия, положения плода, вычисления его предполагаемой массы. Известно, что отставание высоты стояния дна матки на 2 см и более по сравнению с должной величиной для конкретного срока беременности или отсутствие увеличения в течение 2-3 нед указывает на вероятность развития синдрома задержки роста плода. Клиническая оценка состояния его сердечно-сосудистой системы проводится путем аускультации. Приемлемой для женских консультаций является система определения риска фетоплацентарной недостаточности, разработанная О.Г. Фроловой и Е.Н. Николаевой (1976, 1980), представленная в табл. 14.
Важную информацию в родах о функциональных резервах плода несет оценка качества околоплодных вод. В настоящее время выявлены прогностические критерии тяжелого осложнения фетоплацентарной недостаточности - мекониальной аспирации у плода и новорожденного - по характеру околоплодных вод в сочетании с
Таблица 14. Оценка факторов риска перинатальной патологии
 Примечание.
При
сумме баллов 10 и более существует высокий риск перинатальной
патологии, 5-9 баллов указывают на среднюю, 4 и менее - на низкую
степень риска.
Примечание.
При
сумме баллов 10 и более существует высокий риск перинатальной
патологии, 5-9 баллов указывают на среднюю, 4 и менее - на низкую
степень риска.
данными о его сердечной деятельности и дыхательной активности. Создана балльная шкала, учитывающая цвет вод, консистенцию мекония, срок беременности и наличие признаков гипоксии по данным оценки сердечной деятельности плода. При количестве баллов, равном 12, вероятность мекониальной аспирации у плода составляет 50%, 15 и более - 100%. Существенным ограничением клинических методов диагностики является индивидуальная вариабельность размеров живота и матки беременной женщины, которые зависят от антропометрических особенностей, выраженности подкожно-жирового слоя, количества околоплодных вод, положения и количества плодов. Изменения аускультативной картины возникают лишь на поздних стадиях страдания плода и чаще проявляются уже в родах. Оценка состояния околоплодных вод на практике возможна только после их излития, так как амниоскопия малоинформативна, а амниоцентез является инвазивным методом, имеющим ряд ограничений и требующий специальных условий. Почти у 60% беременных клиническими методами плацентарная недостаточность не выявляется. С другой стороны, у каждой из трех беременных с подозрением на синдром задержки роста плода, направляемых на ультразвуковое исследование, клинический диагноз подтверждается.
Лабораторно-инструментальные исследования. При современном комплексном обследовании беременной необходимо:
Выявить основные клинические проявления фетоплацентарной недостаточности, определить степень и форму СЗРП, тяжесть внутриутробной гипоксии;
Оценить степень функциональных и морфологических изменений в фетоплацентарной системе и ее адаптационные возможности;
Установить этиологические факторы и патогенетические механизмы развития фетоплацентарной недостаточности, на основании чего выбрать оптимальный вариант лечения и разработать оптимальную акушерскую тактику.
В связи с этим все большее распространение приобретают методы лабораторно-инструментальной диагностики, позволяющие выявлять нарушения на более ранних стадиях и своевременно приступить к лечебным мероприятиям.
Среди лабораторных методов в последние годы применяют определение гормональной и белоксинтезирующей функции фетоплацентарного комплекса (плацентарный лактоген, прогестерон, эстриол,
кортизол, α-фетопротеин, SP1, PP12 и др.), биохимическое исследование его ферментной активности (аспартатаминотрасфераза, аланинаминотрансфераза, щелочная фосфатаза и др.). Лабораторная диагностика фетоплацентарной недостаточности, основанная на определении уровня гормонов, имеет свои характерные признаки, которые опережают клинические проявления недостаточности плаценты на 2-3 нед. Фетоплацентарная недостаточность в ранние сроки беременности в основном зависит от недостаточной гормональной активности желтого тела, сопровождается низким уровнем прогестерона и хорионического гонадотропина. Позже, во II и III триместрах беременности, развитие ПН сопровождается морфологическими нарушениями, что постепенно обуславливает развитие недостаточности гормонпродуцирующей функции плаценты.
Ранним доклиническим признаком недостаточности плаценты является снижение синтеза всех гормонов фетоплацентарной системы (эстрогенов, прогестерона, плацентарного лактогена), поэтому оптимальным условием для раннего выявления фетоплацентарной недостаточности является динамическое определение гормонов с ранних сроков беременности и до рождения ребенка. Наиболее полную информацию о состоянии плода можно получить при комплексном определении нескольких гормонов. Клиническая значимость определения плацентарного лактогена (ПЛ) в сыворотке крови беременных обусловлена тем, что его концентрация ниже 4 мкг/мл свидетельствует о нарушении функции плаценты при патологически протекающей беременности и является прогностическим признаком нарушения функционального состояния плода. При угрожающем выкидыше падение концентрации ПЛ является наиболее ранним диагностическим показателем неблагоприятного исхода беременности. В случае внутриутробной гибели плода концентрация ПЛ падает значительно раньше, чем регистрируется прекращение сердцебиения плода. Падение ПЛ на 50% и более от среднего уровня свидетельствует о критическом снижении функции плаценты и нарушении состояния плода. При падении ПЛ на 80% происходит антенатальная гибель плода. Диагностическое значение имеет сопоставление концентрации ПЛ в крови и околоплодных водах. Отношение концентрации гормона в крови к его уровню в околоплодных водах в норме составляет от 9:1 до 14:1. При умеренной плацентарной недостаточности оно снижается до 6:1, при тяжелой - менее 6:1. Во второй половине беременности содержание прогесте-
рона является показателем гормональной функции плаценты. При плацентарной недостаточности в зависимости от ее тяжести концентрация прогестерона падает на 30-80%. С другой стороны, при ряде осложнений беременности, когда происходит патологическое увеличение массы плаценты, продукция прогестерона повышается. Так, высокий уровень прогестерона наблюдается у беременных с резус-сенсибилизацией, при тяжелых формах диабета, а также при почечной недостаточности, когда нарушено выведение гормона из крови. В этих случаях повышенная концентрация прогестерона свидетельствует о неблагоприятном прогнозе течения беременности.
Наибольшее практическое значение приобрело определение эстриола как метода мониторного наблюдения за состоянием плода во время беременности. При осложненном течении беременности снижение уровня эстриола служит ранним диагностическим признаком нарушения развития плода. Уменьшение экскреции эстриола с мочой до 12 мг/сут и менее указывает на выраженное ухудшение состояния плода и фетоплацентарной системы. Значительные колебания этого показателя в норме и при гипотрофии плода делают необходимым проведение исследований в динамике. Признаком плацентарной недостаточности является снижение уровня эстриола в околоплодных водах. Для диагностики плацентарной недостаточности определяется эстриоловый индекс - соотношение количества гормона в плазме крови и моче. По мере прогрессирования недостаточности величина индекса снижается. Одной из самых частых причин низкого содержания эстриола в крови беременных является задержка роста плода. Резкое снижение эстриола (менее 2 мг/сут) наблюдается при анэнцефалии плода, гипоплазии его надпочечников, синдроме Дауна, внутриутробной инфекции (токсоплазмоз, краснуха, цитомегаловирусная инфекция). Высокий уровень эстриола наблюдается при многоплодной беременности или при крупном плоде. Кроме состояния плода, имеется ряд экзогенных и эндогенных факторов, оказывающих воздействие на биосинтез, метаболизм и экскрецию эстриола. Так, лечение беременной кортикостероидами вызывает временное подавление функции надпочечников плода, что ведет к снижению уровня эстриола. При лечении беременной глюкокортикоидами или антибиотиками синтез эстриола также снижается. Тяжелые заболевания печени у матери могут приводить к нарушению конъюгации эстрогенов и выведению их с желчью. Изменение функции почек у беременной приводит к снижению клиренса эстри-
ола, в результате чего содержание гормона в моче снижается, уровень его в крови повышается неадекватно состоянию плода. В более редких случаях возникают врожденные ферментные дефекты плаценты, которые могут быть причиной крайне низких значений эстриола, в то время как состояние плода не будет нарушено. Аналогичные закономерности наблюдают при определении содержания эстриола в крови беременных. Особый интерес представляет изучение уровня нейронспецифической енолазы в крови матери и изофермента креатинкиназы в амниотической жидкости как антенатальных маркеров нарушения развития мозга, уровень которых возрастает при гипоксии плода. Следует учитывать, что большинство гормональных и биохимических тестов обладает широкими границами индивидуальных колебаний и низкой специфичностью, для получения достоверных данных требуется определение уровня гормона или фермента в динамике. Общий недостаток указанных тестов заключается в отсутствии возможности интерпретации результата в момент исследования плода.
Указанных недостатков лишены методы эхографии и функциональной оценки состояния плода (кардиотокография, кардиоинтервалография, допплерометрическое исследование кровотока), которые в настоящее время являются ведущими в диагностике плацентарной недостаточности. Основное значение эхографии для диагностики фетоплацентарной недостаточности заключается в выявлении синдрома задержки роста плода и определении его формы и степени тяжести. Ультразвуковая диагностика задержки роста плода основана на сопоставлении фетометрических показателей, полученных в результате исследования, с нормативными показателями для данного срока беременности. Наибольшее распространение в диагностике внутриутробной задержки роста плода получило измерение бипариетального размера головки, средних диаметров грудной клетки и живота, окружностей и площадей поперечного их сечения, а также длины бедренной кости. С целью контроля за развитием плода используют перцентильный подход, который позволяет в каждый конкретный срок беременности точно определить соответствие размеров плода гестационному возрасту, а также степень отклонения их от нормативных величин. Диагноз СЗРП ставится в том случае, если размеры плода ниже 10%о или более чем на два стандартных отклонения ниже среднего значения для данного срока беременности. Исходя из результатов ультразвукового исследования, можно
определить и формы СЗРП (симметричная, асимметричная), которые характеризуются разными соотношениями показателей фетометрии (длина бедра/окружность живота, длина бедра/окружность головки). Возможно формирование «смешанной» формы внутриутробной задержки роста плода. Она характеризуется непропорциональным отставанием всех показателей фетометрии при наиболее выраженном отставании размеров живота. На основании данных фетометрии можно определить степень тяжести задержки роста плода. При I степени отмечается отличие показателей фетометрии от нормативных и соответствие их показателям, которые характерны для беременности на 2 нед меньшего срока (34,2%), при II степени - на 3-4 нед меньшего срока (56,6%), при III - более чем на 4 нед меньшего срока (9,2%). Степень тяжести внутриутробной задержки роста коррелирует со степенью тяжести фетоплацентарной недостаточности и неблагоприятными перинатальными исходами.
R. Deter et al. (1995) предложили новую модифицированную шкалу неонатальной оценки развития (NGAS - N eonatal G rowth A ssessment S core). Она основывается на расчетах индексов потенциальной реализации роста (GRPI - G rowth P otential R ealisation I ndex). Эти индексы можно применять для таких фетометрических параметров, как масса, окружность головы, живота и бедра, а также рост плода. Шкала построена на сравнительной оценке данных, полученных во II триместре беременности с помощью ультразвукового исследования, и данных при рождении. Она оценивает соответствие генетически детерминированного массо-ростового потенциала плода и данных, полученных при рождении. С ее помощью можно оценить имеет ли новорожденный отставание антропометрических показателей или его массо-ростовой потенциал реализован полностью. Шкала может использоваться не только при СЗРП, но и при многоплодной беременности, а также при оценке крупных плодов.
В последнее время эхографическое исследование также используется для оценки состояния пуповины как критерия внутриутробного страдания плода. При диаметре пуповины в сроки беременности 28-41 нед не более 15 мм (тощая пуповина), а диаметре вены и артерий - соответственно 8 и 4 мм, в 66% наблюдений имеются признаки гипоксии плода и в 48% - синдром задержки роста плода. Дополнительным критерием внутриутробного страдания плода и прогностическим признаком дистресса новорожденного авторы считают гиперизвитость пуповины.
Важную информацию о состоянии плода несет его двигательная и дыхательная активность. Наличие регулярно повторяющихся дыхательных движений плода при наличии мекония в околоплодных водах является фактором риска развития аспирационного синдрома. Особенно неблагоприятным прогностическим фактором является длительный период движения типа «gasping» (удушье).
В последнее десятилетие для проведения фетометрии, в том числе при плацентарной недостаточности и СЗРП, используется трехмерное ультразвуковое исследование. Данная методика обладает большей точностью в измерении бипариетального диаметра, окружности головки и окружности живота плода, длины бедренной кости по сравнению с двухмерным УЗИ, особенно при маловодии или неправильных положениях плода в матке. Это дает значительно меньшую ошибку в подсчете предполагаемой массы тела плода (6,2-6,7% против 20,8% при двухмерном УЗИ).
В диагностике плацентарной недостаточности важную роль играет ультразвуковая плацентография, которая, кроме определения локализации плаценты, позволяет оценить ее структуру и величину. Появление II стадии до 32 нед, а III стадии зрелости плаценты до 36 нед беременности свидетельствует о преждевременном ее созревании. В ряде случаев при ультразвуковом исследовании наблюдается кистозное изменение плаценты. Кисты плаценты определяются в виде эхонегативных образований различной формы и величины. Они возникают чаще на плодовой стороне плаценты и образуются за счет кровоизлияний, размягчения, инфарктов и других дегенеративных изменений. В зависимости от патологии беременности недостаточность функции плаценты проявляется уменьшением или увеличением толщины плаценты. Так, характерна для гестозов, угрозы прерывания беременности, СЗРП «тонкая» плацента (до 20 мм в III триместре беременности). При гемолитической болезни и сахарном диабете о плацентарной недостаточности свидетельствует «толстая» плацента (до 50 мм и более). Одним из наиболее широко распространенных методов функциональной оценки состояния плода является кардиотокография. Наряду с показателями сердечной деятельности плода, данный метод позволяет регистрировать двигательную активность плода и сократительную активность матки. Наиболее широко применяется нестрессовый тест, который оценивает характер сердечной деятельности плода в естественных условиях. Реже изучается реакция плода на те или иные «внешние» воздействия (звук,
сокращения матки под влиянием экзогенного окситоцина и т.д.). При наличии синдрома задержки роста плода нестрессовый тест в 12% наблюдений обнаруживает тахикардию плода, в 28% - снижение вариабельности базального ритма, в 28% - вариабельные децелерации, в 13% - поздние децелерации. В то же время следует учитывать, что в связи со сроками формирования миокардиального рефлекса (к 32-й нед беременности) визуальная оценка кардиотокограмм возможна только в III триместре беременности. Кроме того, как показывают результаты экспертных оценок, частота расхождений при визуальной оценке кардиотокограмм несколькими специалистами может достигать 37-78%. Характер кардиотокографической кривой зависит не только от срока беременности, но и от пола плода, массы тела, особенностей ведения родов (обезболивание, родовозбуждение, родостимуляция). В последние годы большое распространение получило определение при эхографическом исследовании так называемого биофизического профиля плода (табл. 15). Данный тест включает комплексную балльную оценку (шкала от 0 до 2 баллов) количества околоплодных вод, двигательной активности и мышечного тонуса плода, дыхательных движений, а также результатов нестрессового кардиотокографического теста.
8-10 баллов свидетельствуют о нормальном состоянии плода. Повторное исследование следует проводить только у беременных группы высокого риска через 1-2 нед. При оценке 4-6 баллов акушерская тактика определяется с учетом признаков зрелости плода и подготовленности родовых путей. В случаях недостаточной зрелости плода и отсутствии готовности родовых путей исследование повторяют через 24 ч. При получении повторного неблагоприятного результата необходимо проведение терапии кортикостероидами с последующим родоразрешением не ранее чем через 48 ч. При наличии признаков зрелости плода показано родоразрешение. Оценка 0-2 балла является показанием для срочного и бережного родоразрешения. При отсутствии признаков зрелости плода родоразрешение необходимо проводить после 48-часовой подготовки беременной кортикостероидами.
Параметр | Баллы |
|
Количество околоплодных вод | Околоплодные воды визуализируются в большей части полости матки. Наибольший вертикальный размер свободного участка вод превышает 1 см | Околоплодные воды не визуализируются в большей части полости матки. Наибольший вертикальный размер свободного участка вод не превышает 1 см |
Двигательная активность плода | Наличие не менее трех отдельных движений туловища плода в течение 30 мин наблюдения | Наличие двух отдельных движений туловища плода и менее в течение 30 мин наблюдения |
Дыхательные движения плода | Регистрация за 30 мин не менее одного эпизода дыхательных движений плода продолжительностью 30 с и более | Отсутствие дыхательных движений плода или регистрация эпизода дыхательных движений продолжительностью менее 30 с на протяжении 30 мин |
Мышечный тонус плода | Конечности плода находятся в состоянии флексии;туловище несколько согнуто; головка плода прижата к груди. После совершения движения плод возвращается в исходное положение | Конечности и туловище плода частично или полностью разогнуты, кисть раскрыта. После совершения движения плод не возвращается к состоянию флексии |
Нестрессовый тест | Наличие двух акцелераций и более с амплитудой не менее 15 ударов и продолжительностью не менее 15 с на протяжении 40 мин исследования | Наличие менее двух акцелераций с амплитудой не менее 15 ударов и продолжительностью не менее 15 с на протяжении 40 мин исследования |
только о становлении маточно-плацентарного и плодово-плацентарного кровообращения, но и выявляет гемодинамические маркеры хромосомной патологии. Внутриплацентарное кровообращение (кровоток в спиральных артериях и терминальных ветвях артерии пуповины) при неосложненной беременности характеризуется прогрессивным снижением сосудистой резистентности, отражающим основные этапы морфогенеза плаценты. Наиболее выражено снижение сосудистого сопротивления в спиральных артериях в сроки 13-15 нед, а в терминальных ветвях артерии пуповины - в 24-26 нед, что на 3-4 нед опережает пик снижения сосудистой резистентности в маточных артериях и терминальных ветвях артерии пуповины. При исследовании кровотока в маточных артериях, артерии пуповины и внутриплацентарного кровообращения принципиально важным для прогнозирования развития гестоза и плацентарной недостаточности, начиная с 14-16 нед беременности, является тот факт, что нарушения внутриплацентарного кровотока выявляются на 3-4 нед ранее таковых в магистральных звеньях.
Наиболее важным исследование маточно-плацентарного и плодово-плацентарного кровообращения с целью прогнозирования развития и ранней диагностики гестоза и фетоплацентарной недостаточности становится во II триместре беременности. Кроме повышения индексов сосудистого сопротивления в маточных артериях, возможно появление дикротической выемки в фазу ранней диастолы. При выявлении патологических показателей гемодинамики в системе мать-плацента-плод пациентки относятся к группе высокого риска по развитию гестоза и фетоплацентарной недостаточности и нуждаются в проведении дифференцированной медикаментозной коррекции выявленных гемодинамических нарушений. При нарушениях в маточно-плацентарном звене кровообращения препаратами выбора являются средства, улучшающие реологические свойства крови (пентоксифиллин, ацетилсалициловая кислота), при нарушениях в плодово-плацентарном звене целесообразно использование гемодеривата. В подавляющем большинстве наблюдений осложненной беременности и экстрагенитальных заболеваний начальным этапом развития патологического процесса является нарушения маточноплацентарного кровотока с постепенным вовлечением в патологический процесс плодово-плацентарного звена кровообращения и сердечно-сосудистой системы плода. Указанная последовательность патогенетических механизмов развития нарушений гемодинамики
представлена в разработанной А.Н. Стрижаковым и соавт. (1986) классификации нарушений кровотока в системе мать-плацентаплод:
IA степень - нарушение маточно-плацентарного кровотока при сохранном плодово-плацентарном;
IB степень - нарушение плодово-плацентарного кровотока при сохранном маточно-плацентарном;
II степень - одновременное нарушение маточно-плацентарного и плодово-плацентарного кровотока, не достигающее критических значений (сохранение положительно направленного диастолического кровотока в артерии пуповины);
III степень - критическое нарушение плодово-плацентарного кровотока (отсутствие или ретроградное направление конечнодиастолического кровотока) при сохраненном или нарушенном маточно-плацентарном кровотоке.
Снижение скоростей кровотока в артерии пуповины в диастолу до нулевых значений или появление ретроградного тока крови свидетельствует о значительном увеличении сосудистого сопротивления в плаценте, что обычно сочетается с критически высоким уровнем накопления лактата, гиперкапнии, гипоксемии и ацидемии у плода.
При комплексном исследовании артериального кровообращения плода при наиболее частом осложнении беременности - фетоплацентарной недостаточности - отмечают следующие изменения:
Повышение индексов сосудистого сопротивления в артерии пуповины (СДО более 3,0);
Повышение индексов сосудистого сопротивления в аорте плода
(СДО более 8,0);
Снижение индексов сосудистого сопротивления в средней мозговой артерии (СДО менее 2,8);
Снижение кровотока в почечных артериях;
Нарушение внутрисердечной гемодинамики (появление реверсного кровотока через трикуспидальный клапан).
При фетоплацентарной недостаточности происходят нарушения внутрисердечной гемодинамики плода, заключающиеся в изменении отношения максимальных скоростей кровотока через клапаны в пользу левых отделов сердца, а также наличие регургитационного потока через трикуспидальный клапан. При критическом состоянии плода выявляют следующие изменения плодовой гемодинамики:
Нулевой или отрицательный кровоток в артерии пуповины;
Регургитация через трикуспидальный клапан;
Отсутствие диастолического компонента кровотока в аорте плода;
Повышение диастолического компонента кровотока в средней мозговой артерии;
Нарушение кровотока в венозном протоке и нижней полой вене, при этом допплерометрический критерий нарушения кровотока в венозном протоке - снижение скорости кровотока в фазу поздней диастолы, вплоть до нулевых или отрицательных значений. При критическом состоянии плода пульсационный индекс в венозном протоке превышает 0,7. Допплерометрическими критериями нарушений кровотока в нижней полой вене являются увеличение скорости реверсного потока крови более 27,5-29% и появление нулевого или реверсного кровотока между систолическим и ранним диастолическим потоками.
Дифференциальный диагноз. Предложен целый ряд критериев, позволяющих провести дифференциальную диагностику между синдромом задержки роста плода с конституционально небольшим плодом («плод, малый для срока беременности»). Некоторые из критериев используют при оценке состояния плода, другие - новорожденного.
1. Оценка тенденции роста плода на основании рассчитанных индексов потенциальной реализации роста (GRPI - G rowth P otential R ealisation I ndex). Эти индексы можно применять для таких фетометрических параметров, как масса, окружность головы, живота и бедра, а также рост плода. Шкала построена на сравнительной оценке данных, полученных во II триместре беременности с помощью ультразвукового исследования, и данных при рождении.
2. Использование при диагностике СЗРП комплекса показателей (расчет предполагаемой массы плода, оценка количества околоплодных вод, наличие гипертензии у матери) позволяет повысить точность диагностики СЗРП до 85%.
3. Допплерометрическое исследование кровотока в артерии пуповины и маточных артериях.
4. Расчет пондералового индекса
Пондераловый индекс = вес в г? 100 / длина в см? 3.
5. Возрастание числа ядерных форм эритроцитов в крови плода, полученной при кордоцентезе (обусловлено гипоксией при наличии
ПН и СЗРП).
6. Особенности прибавки массы тела после рождения (25% новорожденных с тяжелой (III) степенью СЗРП до 24 мес жизни сохраняют отставание массо-ростовых показателей ниже 3%о).
Рутинный пренатальный скрининг для диагностики плацентарной недостаточности и обусловленным ею СЗРП включает:
Выявление беременных группы высокого риска ПН и СЗРП;
Оценка высоты стояния дна матки на протяжении беременности;
Биохимический скрининг (двойной и тройной тесты); детальное ультразвуковое исследование в 10-14 нед, 20-24 нед,
30-34 нед гестации с оценкой анатомии плода, выявлением маркеров хромосомных аномалий, внутриутробного инфицирования, пороков развития плода;
Ультразвуковая фетометрия в указанные сроки с диагностикой СЗРП симметричной и асимметричной формы, оценка степени тяжести синдрома;
Оценка количества околоплодных вод;
Оценка степени зрелости плаценты;
Допплерометрия кровотока в маточных, спиральных артериях, артерии пуповины и ее терминальных ветвях в 16-19 нед, 24- 28 нед, 32-36 нед гестации;
Оценка гемодинамики плода (средняя мозговая артерия, аорта, почечные артерии, венозный проток, нижняя полая вена);
Кардиотокография (при сроке более 28 нед гестации).
Кроме того, по показаниям, могут применяться инвазивные методы исследования (амниоцентез, биопсия ворсин хориона, плацентоцентез, кордоцентез) с последующим кариотипированием при высоком риске наличия хромосомных аномалий и генных дефектов у плода.
Среди профилактических мероприятий следует указать на:
Лечение экстрагенитальных заболеваний до наступления беременности;
Коррекцию метаболических нарушений и артериального давления с ранних сроков гестации;
Соблюдение рационального режима питания и режима дня беременной;
Назначение антиагрегантов (ацетилсалициловая кислота - 100 мг/сут, дипиридамол - 75 мг/сут, пентоксифиллин - 300 мг/сут) и антикоагулянтов (НМГ);
Применение депротиенизированного гемодеривата (по 200 мг 3 раза в сут, 21-30 сут);
Использование гестагенов (дидрогестерон, микронизированный прогестерон) у беременных с привычной потерей беременности с ранних сроков гестации;
Назначение поливитаминных комплексов.
Терапия ПН и СЗРП должна быть направлена на: улучшение маточно-плацентарного и плодово-плацентарного кровотока; интенсификацию газообмена; коррекцию реологических и коагуляционных свойств крови; устранение гиповолемии и гипопротеинемии; нормализацию сосудистого тонуса и сократительной активности матки; усиление антиоксидантной защиты; оптимизацию метаболических и обменных процессов.
Показания к госпитализации. Субкомпенсированная и декомпенсированная ПН, сочетание ПН и СЗРП с экстрагенитальной патологией, гестозом, угрожающими преждевременными родами.
Медикаментозное лечение. Учитывая, что среди причин плацентарной недостаточности большое значение имеют повреждающее воздействие химических агентов, несбалансированное питание, экстрагенитальные и инфекционные заболевания, гестоз, длительная угроза прерывания беременности и другие осложнения беременности, методически верно начинать лечение при ПН с ликвидации неблагоприятного влияния этих этиологических факторов. Нормализация пищевого рациона в группе беременных с низким уровнем жизни за счет повышения содержания белка и основных минералов при уменьшении доли жиров и углеводов до сбалансированного уровня позволяет снизить частоту развития СЗРП на 19%.
Большое значение в лечении фетоплацентарной недостаточности придается нормализации тонуса матки, так как его повышение способствует нарушению кровообращения в межворсинчатом пространстве вследствие снижения венозного оттока. С этой целью применяют препараты спазмолитического действия и токолитики (фенотерол, гексопреналин). Как показали проведенные нами исследования, при адекватном лечении ПН на фоне угрозы прерывания беременности в 90% наблюдений удается получить положительный эффект. Эффективность терапии компенсированной и субкомпенсированной форм плацентарной недостаточности на фоне анемии беременных приближается к 100%. Также достаточно эффективно лечение ПН с использованием антибактериальных препаратов при
внутриутробном инфицировании (положительный эффект в 71,4% наблюдений). Вместе с тем у беременных с гестозом лечение плацентарной недостаточности эффективно только в 28,1% при начальных нарушениях кровообращения в системе мать-плацента-плод, что, вероятно, связано с морфологическими нарушениями в процессе формирования плаценты.
Наиболее распространенными медикаментозными средствами при лечении плацентарной недостаточности являются антиагреганты и антикоагулянты. Из этой группы препаратов обычно применяют ацетилсалициловую ксилоту, дипиридамол, пентоксифиллин, никошпан, ксантинол, гепарин. Уменьшение проявлений плацентарной недостаточности при лечении антиагрегантами и антикоагулянтами обусловлено усилением активности периферического цитотрофобласта, уменьшением объема межворсинчатого фибриноида, склеенных ворсин, межворсинчатых кровоизлияний, инфарктов плаценты. Применение антиагрегантов наиболее эффективно при чрезмерной активации сосудисто-тромбоцитарного звена системы гемостаза, при более тяжелых нарушениях, включающих также патологическое усиление плазменного звена, целесообразно дополнение лечения гепарином. Данный препарат оказывает антигипоксическое действие, участвует в регуляции тканевого гемостаза и ферментных процессах. Гепарин не проникает через плацентарный барьер и не оказывает повреждающего действия на плод. В последние годы при лечении плацентарной недостаточности применяют НМГ, обладающие более выраженной противотромботической активностью и дающие меньше побочных эффектов.
Учитывая связь показателей маточно-плацентарного кровотока и активности ферментов крови у беременных с высоким риском перинатальной патологии, целесообразно проводить метаболическую терапию с использованием АТФ, препарата инозин-Ф, кокарбоксилазы, витаминов и антиоксидантов, а также гипербарической оксигенации для профилактики и лечения гипоксии плода. Метаболическая терапия является обязательным компонентом в лечении ПН, так как она снижает интенсивность липидной пероксидации. Для стабилизации структурно-функциональных свойств клеточных мембран, улучшения трофики плода используют мембраностабилизаторы - витамин Е и эссенциале. В настоящее время метаболическая терапия фетоплацентарной недостаточности, как в амбулаторных, так и в стационарных условиях включает применение высокоочищенного
гемодеривата из телячьей крови с низкомолекулярными пептидами и дериватами нуклеиновых кислот. Основой фармакологического действия является влияние на процессы внутриклеточного метаболизма, улучшение транспорта глюкозы и поглощения кислорода в тканях. Включение в клетку большого количества кислорода приводит к активизации процессов аэробного гликолиза, возрастанию энергетического потенциала клетки. При лечении ПН актовегин активирует клеточный метаболизм путем увеличения транспорта, накопления и усиления внутриклеточной утилизации глюкозы и кислорода. Эти процессы приводят к ускорению метаболизма АТФ и повышению энергетических ресурсов клетки. Вторичным эффектом является усиление кровоснабжения. Основой противоишемического действия актовегина является так же антиоксидантное действие (активация фермента супероксиддисмутазы). Актовегин применяется в виде внутривенных инфузий по 80-200 мг (2-5 мл) в 200 мл 5% раствора глюкозы (? 10) или в драже (1 драже 3 раза в сут в течение 3 нед). Доказан нейропротективный эффект актовегина в отношении головного мозга плода, находящегося в условиях гипоксии. Он также обладает анаболическим действием, что играет положительную роль
при СЗРП.
При субкомпенсированных и декомпенсированных формах ПН также возможно сочетанное применение актовегина и инстенона, комбинированного препарата, сочетающего в себе ноотропный, сосудистый и нейротонический компоненты.
Достаточное снабжение кислородом плода играет большую роль в его жизнеобеспечении. В связи с этим при ПН показана оксигенотерапия, однако следует учитывать развитие защитных реакций при вдыхании избытка 100% кислорода, поэтому используют 30- 60-минутные ингаляции газовой смеси с концентрацией кислорода не более 50%.
Важным компонентом терапии ПН на фоне экстрагенитальной патологии и осложнений беременности является инфузионная терапия. Одной из наиболее важных составляющих комплекса лечебных мероприятий при плацентарной недостаточности является обеспечение энергетической потребностей плода за счет введения глюкозы в форме внутривенных инфузий в сочетании с адекватным количеством инсулина.
Не утратила своего терапевтического значения инфузия глюкозоновокаиновой смеси как средства уменьшения сосудистого спазма,
улучшения микроциркуляции и кровотока в артериальных сосудах плаценты. Внутривенное введение озонированного изотонического раствора хлорида натрия способствует нормализации состояния плода при наличии лабораторно-инструментальных признаков гипоксии.
С целью коррекции гиповолемии, улучшения реологических свойств крови и микроциркуляции в плаценте эффективным является введение реополиглюкина и растворов на основе гидроксиэтилированного крахмала. Инфузии 10% раствора гидрокисэтилированного крахмала при лечении ПН на фоне гестоза позволяют добиться достоверного снижения показателей сосудистой резистентности в маточных артериях, а перинатальная смертность уменьшается с 14 до 4%. При выявлении гипопротеинемии у беременных и наличии нарушений в плазменном звене системы гемостаза осуществляют инфузии свежезамороженной плазмы в количестве 100-200 мл 2- 3 раза в нед. При белковой недостаточности, выраженной потере или повышенной потребности в белках, в частности при СЗРП, возможно применение инфузионной терапии препаратами, содержащими раствор аминокислот (аминосол L-800, аминостерил КЕ 10% безуглеводный, инфезол 40). Следует учитывать, что увеличение концентрации аминокислот в крови матери не всегда приводит к увеличению их содержания у плода.
Кроме того, в лечении ФП большое значение имеют физические методы воздействия (электрорелаксация матки, электрофорез магния, назначение тепловых процедур на околопочечную область), которые расслабляют миометрий и приводят к расширению сосудов.
Новым методом в лечении беременных с ПН является проведение сеансов лечебного плазмафереза. Применение дискретного плазмафереза при отсутствии эффекта от лечения ПН медикаментозными препаратами позволяет улучшить метаболическую, гормонпродуцирующую функции плаценты и способствует нормализации фето- и маточно-плацентарного кровотока.
Лечение плацентарной недостаточности эффективно, если первый курс начинается до 26 нед беременности, а повторный в 32-34 нед. Лечение в более поздние сроки улучшает состояние плода и повышает устойчивость к гипоксии, однако не позволяет нормализовать его состояние и обеспечить адекватный рост. Высокая частота неблагоприятных перинатальных исходов при СЗРП во многом обусловлена необходимостью досрочного родоразрешения в сроках,
когда новорожденный плохо адаптируется к внешней среде (в среднем 31-33 нед). При решении вопроса о досрочном родоразрешении в комплекс подготовки к родам включают кортикостероиды для профилактики осложнений в неонатальном периоде. Эти препараты не только ускоряют процесс созревания легких плода, но и снижают частоту некоторых осложнений. По данным Американского национального института здоровья (1995), частота внутрижелудочковых кровоизлияний и энтероколитов у новорожденных с СЗРП ниже в наблюдениях пренатального назначения кортикостероидов. Дексаметазон назначается per os 8-12-16 мг в течение 3 дней или в/м 4 мг каждые 12 ч 4 раза.
Обязательным является разъяснение женщине необходимости соблюдения рационального режима питания, сна и отдыха во время беременности. Следует обучить пациентку контролю за массой тела, артериальным давлением. Для диагностики гипоксии следует обучить женщину подсчету шевелений плода на протяжении 1 сут и разъяснить ситуации, при которых она должна немедленно обратиться за медицинской помощью.
Для компенсированной ПН характерны благоприятные перинатальные исходы. Самопроизвольные роды через естественные родовые пути происходят в 75,82% наблюдениях, без осложнений - в 69,57%. Наиболее часто течение родового акта при компенсированной ПН осложняется патологическим прелиминарным периодом, прогрессированием хронической внутриутробной гипоксии плода, несвоевременным излитием околоплодных вод, слабостью и дискоординацией родовой деятельности. Возникновение данных осложнений беременности является показанием для экстренного родоразрешения путем операции в 38,1% наблюдений. Показаниями к плановой операции кесарева сечения в большинстве наблюдений являются отягощенный акушерско-гинекологический анамнез (в том числе рубец на матке после предыдущей операции кесарева сечения, бесплодие, синдром потери беременности) в сочетании с компенсированной ПН, а также осложненным течением беременности, а также наличие признаков нарушения состояния плода (СЗРП I степени, нарушения гемодинамики в системе мать-плацента-плод IA или IB степени, начальные признаки гипоксии плода), у женщин старшей возрастной группы - при наличии перенашивания беременности. По мере усугубления степени тяжести ПН частота благоприятного исхода самопроизвольных родов снижается, в связи с чем
при субкомпенсированной ПН методом выбора является плановое родоразрешение путем операции кесарева сечения в сроки, близкие к доношенным.
Показаниями к плановому родоразрешению путем операции кесарева сечения при субкомпенсированной ПН являются:
Умеренно выраженная гипоксия плода (снижение вариабельности базального ритма, числа акцелераций, их амплитуды и продолжительности);
Гемодинамические нарушения в системе мать-плацента-плод II степени при наличии двусторонних изменений и дикротической выемки в маточных артериях;
С другой акушерской патологией;
Синдром задержки роста плода в сочетании с гестозом или перенашиванием беременности.
Критериями пролонгирования беременности при субкомпенсированной ПН являются:
СЗРП I-II степени при наличии адекватного прироста фетометрических показателей при контрольном УЗИ с интервалами 7 дней;
СЗРП III степени без нарастания отставания фетометрических показателей на фоне непрогрессирующих нарушений плодовоплацентарного кровообращения и/или начальных признаков централизации кровотока (СДО в аорте плода более 8,0 при значениях СДО в СМА 2,8-9,0 в сроки 33-37 нед);
Отсутствие выраженных нарушений маточно-плацентарного кровотока (односторонние, без нарушения спектра кровотока в маточных артериях, СДО более 2,4) при гестозе средней степени тяжести;
Отсутствие клинического прогрессирования сочетанного гестоза;
Начальные признаки гипоксии по данным кардиотокографии при отсутствии или начальной централизации артериального плодового кровообращения, нормальные показатели органного (почечного) кровотока плода (СДО не более 5,2 в сроки до 32 нед, и не более 4,5 в сроки 33-37 нед);
Эукинетический и гиперкинетический тип центральной гемодинамики плода при отсутствии нарушений внутрисердечной гемодинамики.
Комплексное исследование гемодинамики плода и анализ перинатальных исходов при плацентарной недостаточности позволили
разработать показания к срочному родоразрешению путем операции кесарева сечения при данной патологии. К ним относятся:
Кардиотокографические признаки тяжелой гипоксии плода (спонтанные децелерации на фоне монотонного ритма и низкой вариабельности, поздние децелерации при окситоциновом тесте);
Критическое состояние плодово-плацентарного кровотока при сроке беременности более 34 нед;
Выраженные нарушения кровотока в венозном протоке и нижней полой вене.
Показаниями к экстренному родоразрешению является начало родовой деятельности у беременных с субкомпенсированной ПН, а также преждевременное излитие околоплодных вод. Показанием для перевода новорожденного в отделение интенсивной терапии является недоношенность, гипоксически-ишемическое поражение ЦНС различной степени тяжести.
Показания к срочному родоразрешению путем операции кесарево сечение при декомпенсированной ПН:
СЗРП тяжелой степени с признаками выраженной централизации артериального кровотока плода с нарушениями внутрисердечного кровотока и признаками среднетяжелой гипоксии плода, по данным КТГ;
Прогрессирование гестоза на фоне комплексной терапии с выраженными нарушениями маточно-плацентарного кровотока (двусторонние нарушения с дикротической выемкой на спектре);
Срок беременности при наличии признаков декомпенсирвоанной ПН более 36 нед.
Показания к экстренному родоразрешению:
Нарушения венозного кровотока плода (ретроградный кровоток в венозном протоке, возрастание реверсного потока крови в нижней полой вене плода), наличие пульсаций в вене пуповины;
Преэклампсия и эклампсия.
При недоношенной беременности (32-36 нед) и отсутствии нулевых и ретроградных значений кровотока в венозном протоке в течение предсердной систолы и пульсационном индексе до 0,74, при проценте реверсного кровотока в нижней полой вене до 43,2% в сроки до 32 нед и до 34,1% в сроки 32-37 нед беременность следует пролонгировать. Одновременно проводится комплексное лечение с обязательным внутривенным введением раствора инстенона пла-
центарной недостаточности при ежедневном допплерометрическом и кардиотокографическом контроле. В комплекс лечения включают глюкокортикоиды для ускорения созревания плода.
Родоразрешение осуществляется путем операции кесарева сечения при появлении признаков прогрессирования нарушений венозного кровотока или появлении спонтанных децелераций, гипокинетичского типа гемодинамики и «взрослый» тип чрезклапанного кровотока плода. Продолжительность пролонгирования беременности составила от 4 (в сроке 35-36 нед) до 16 дней (в сроке 32-34 нед).
Своевременная диагностика плацентарной недостаточности и СЗРП, правильное и грамотное ведение беременны, позволяет пролонгировать беременность до срока рождения жизнеспособного плода с благоприятным перинатальным исходом. Выбор срока родоразрешения должен основываться на совокупности диагностических тестов. При досрочном родоразрешении необходимо принимать во внимание наличие условий для интенсивной терапии и реанимационной помощи новорожденным.
Дети с низкой массой тела при рождении в дальнейшем имеют высокий риск нарушений физического, нервно-психического развития и повышенной соматической заболеваемости. Наиболее часто у новорожденного отмечаются следующие осложнения:
Нарушения кардиопульмонарной адаптации с перинатальной асфиксией, мекониальной аспирацией или персистирующей легочной гипертензией;
При сочетании СЗРП с недоношенностью - высокий риск неонатальной смерти, некротического энтероколита, респираторного дистресс-синдрома, внутрижелудочковые кровоизлияния;
Нарушения терморегуляции вследствие возрастания теплоотдачи (вследствие уменьшения подкожножирового слоя) или снижение продукции тепла (истощение катехоламинов и сниженная доставка питательных веществ);
Гипогликемия (у 19,1% новорожденных);
Полицитемия и гиперкоагуляция (диагностируется в 9,5% при I степени СЗРП и в 41,5% - при III степени);
Сниженная иммунореактивность (у 50% новорожденных с III степенью СЗРП выявляется нейтропения, у 55% - нозокомиальные инфекции).
Новорожденные с малой массой при рождении имеют разные варианты физического развития, зависящие от этиологии и тяжести
задержки внутриутробного роста. При СЗРП средней степени тяжести в течение 6-12 мес после рождения отмечают высокие темпы роста, на протяжении которых дети достигают нормальных весо-ростовых отношений. В тоже время, по некоторым данным, новорожденные достигают нормальной массы тела на протяжении 6 мес после рождения, но сохраняют дефицит роста 0,75 стандартных отклонения на протяжении первых 47 мес жизни по сравнению с детьми, имеющими нормальную массу тела при рождении. При СЗРП тяжелой степени дети сохраняют отставание в массе и росте ниже 10%о не только в детстве, но и в подростковом периоде. Так, средний рост в возрасте 17 лет при тяжелой задержке внутриутробного роста составляет 169 см у мальчиков и 159 см у девочек против 175 и 163 см при нормальной массе тела при рождении соответственно.
Многими исследователями при тяжелой степени СЗРП (вес при рождении менее 3%), особенно при недоношенной беременности, отмечается снижение IQ и значительные трудности в обучении. Так, в возрасте до 5 лет в 2,4 раза чаще, чем при нормальной массе тела при рождении, дети имеют малые мозговые дисфункции, двигательные нарушения, церебральные параличи и плохие когнитивные способности; 16% детей в возрасте 9 лет нуждаются в коррекционном обучении; 32% подростков при СЗРП тяжелой степени имеют существенные проблемы в обучении, не позволяющие им закончить полный курс средней школы. В исследовании, проведенном L.M. McCowan (2002), низкий индекс психического развития (MDI) имеют 44% новорожденных при СЗРП, обусловленном гипертензией беременных. Нарушения психимоторного развития чаще отмечают у новорожденных, не получавших грудного вскармливания в течение хотя бы первых 3 мес жизни, длительно находившихся в стационаре, требовавших искусственной вентиляции легких.
Плацента — временный орган, формирующийся только во время беременности и выполняющий функции снабжения плода всем необходимым для здорового развития. Плацентарной недостаточностью называют нарушение ее строения и функций. Другими совами, это расстройство кровотока в системе плод-плацента-мать. Оно в тяжелых случаях может привести даже к гибели ребенка. Итак, узнаем о причинах, терапии и последствиях плацентарной недостаточности.
Почему она возникает
Причины возникновения патологии делят на эндогенные (действующие изнутри организма) и экзогенные (воздействующие снаружи). Последние — это загазованность воздуха, радиоактивное облучение, стрессы, неполноценное питание, профессиональные вредности, использование агрессивной бытовой химии. Негативно влиять на состояние плаценты могут и чрезмерные физические нагрузки будущей мамы. К экзогенным факторам плацентарной недостаточности относятся вредные привычки, прежде всего, курение будущей матери, употребление спиртных напитков, увлечение крепким кофе.
Что касается экзогенных факторов, то к таковым относят возраст будущих рожениц старше 35 и моложе 18; многочисленные роды и аборты; опухоли яичников; рождение в анамнезе гипотрофичных детей; привычное невынашивание; воспалительные процессы половых органов.
Практика показывает, что очень часто причиной плацентарной недостаточности являются соматические заболевания матери. Речь идет о сахарном диабете, гипертонии, пороке сердца, болезнях крови и почек. В группе риска находятся и женщины с врожденными патологиями репродуктивных органов, например, двурогой или седловидной маткой.
Лечение плацентарной недостаточности
Главной задачей терапии является сохранение беременности и своевременное родоразрешение.
Госпитализируют в обязательном порядке женщин с острой формой плацентарной недостаточности, задержкой развития плода по результатам УЗИ и допплерографии. Им нужно полноценно отдыхать, рационально питаться, много времени проводить на свежем воздухе.
Для нормализации кровотока таким пациенткам назначают препараты, которые улучшают тканевый обмен веществ. Это Актовегин, Троксевазин, аскорбиновая кислота, токоферол. Женщинам с таким диагнозом прописывают реокорректоры: Инфукол, Реополиглюкин, Реосорбилакт. Показано введение сернокислой магнезии, Эуфиллина, глюкозо-новокаиновой смеси внутривенно.
Для улучшения свойств крови назначают Трентал и Курантил, Клексан, Фраксипарин. Эти препараты разжижают кровь, предотвращают возникновение патологических образований в плаценте.
Будущим мамам с нарушениями функций плаценты назначают лекарственные средства, улучшающие кровообращение в головном мозге, например, Пирацетам, Ноотропил. Восстанавливают газообмен в плаценте с помощью оксигенотерапии увлажненным кислородом и антигипоксантов. Это Милдронат, Цитохром С, Кавинтон. Прием седативных препаратов показан для снятия возбудимости головного мозга.
Как правило, в стационарных условиях терапия плацентарной недостаточности длится не менее четырех недель. Затем при улучшении состояния плаценты терапия продолжается амбулаторно. Общий курс лечения занимает 6-8 недель. Его эффективность оценивается с помощью УЗИ, КТГ, допплерографии.
Родоразрешение таких пациенток естественным путем проводится при зрелой шейке матки и компенсированной плацентарной недостаточности. Рекомендуется вести роды с эпидуральной анестезией. Если возникает ослабление родовой деятельности, то стимуляцию проводят простагландинами.
Досрочное родоразрешение женщинам с плацентарной недостаточностью показано при отсутствии положительной динамики лечения и диагностированной гипотрофии плода.
Последствия патологии
Если беременность протекает на фоне плацентарной недостаточности, то нередко могут развиваться отслойка плаценты и перенашивание. Существует риск внутриутробной смерти плода.
Для ребенка такой диагноз грозит интранатальной гипоксией с нарушением мозгового кровообращения, неврологическими расстройствами, склонностью к простудным заболеваниям, пороками развития.
Плацентарная недостаточность - синдром, обусловленный морфофункциональными изменениями в плаценте, при прогрессировании которых развивается ЗРП, нередко сочетающаяся с гипоксией.
СИНОНИМЫ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Фетоплацентарная недостаточность - часто употребляемый синоним, который нельзя признать удачным, поскольку он не корректен по форме и сути.
КОД ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ ПО МКБ-10
Класс XV. Беременность, роды и послеродовый период (O00–O99)
Медицинская помощь матери в связи с состоянием плода, амниотической полости и возможными трудностями родоразрешения (O30–O48)
O36. Медицинская помощь матери при других установленных или предполагаемых патологических состояниях плода.
Класс XVI. Отдельные состояния, возникающие в перинатальном периоде (P00–P96)
Поражения плода и новорождённого, обусловленные состояниями матери, осложнениями беременности, родов и родоразрешения (P00–P04)
P02. Поражения плода и новорождённого, обусловленные осложнениями со стороны плаценты, пуповины и плодных оболочек. Расстройства, связанные с продолжительностью беременности и ростом плода (P05–P08)
P05. Замедленный рост и недостаточность питания плода.
P07. Расстройства, связанные с укорочением срока беременности и малой массой тела при рождении, не классифицированные в других рубриках.
ЭПИДЕМИОЛОГИЯ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Плацентарная недостаточность одно из наиболее распространённых осложнений беременности, встречается при невынашивании в 50–77%, при гестозе - в 32%, при сочетании беременности с экстрагенитальной патологией - в 25–45%, у беременных, перенесших вирусную и бактериальную инфекцию, - более чем в 60% наблюдений. ПС у женщин, перенесших плацентарную недостаточность, составляет среди доношенных новорожденных 10,3%, среди недоношенных - 49%. В 60 % плацентарная недостаточность приводит к задержке развития плода .
КЛАССИФИКАЦИЯ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Разработан широкий спектр классификаций плацентарной недостаточности. Часть из них носит условный характер. Наиболее распространёнными и принятыми являются следующие классификации.
Виды плацентарной недостаточности по времени и механизму возникновения.
· Первичная - возникает до 16 нед беременности и связана с нарушениями процессов имплантации и плацентации.
· Вторичная - развивается на фоне уже сформированной плаценты (после 16-й нед беременности) под влиянием экзогенных по отношению к плоду и плаценте факторов.
Виды плацентарной недостаточности по клиническому течению:
· Острая - чаще всего связана с отслойкой нормально или низко расположенной плаценты, возникает преимущественно в родах.
· Хроническая - может возникать в различные сроки беременности.
- Компенсированная - нарушены метаболические процессы в плаценте, отсутствуют нарушения маточно- плацентарного и плодовоплацентарного кровообращения (по данным допплерометрического исследования в артериях функциональной системы мать-плацента-плод).
- Декомпенсированная - определяются нарушения маточноплацентарного и/или плодовоплацентарного кровообращения (по данным допплерометрического исследования в артериях функциональной системы мать-плацента-плод).
Выделяют следующие степени геодинамических нарушений в артериях функциональной системы мать-плацента-плод.
· Степень I - нарушение маточноплацентарного или плодовоплацентарного кровотока.
· Степень II - нарушение маточноплацентарного и плодовоплацентарного кровотока.
· Степень III - централизация плодовоплацентарного кровотока, нарушение маточного кровотока.
· Степень IV - критические нарушения плодовоплацентарного кровотока (нулевой или реверсивный диастолический кровоток в артерии пуповины или аорте, нарушение маточного кровотока).
Виды плацентарной недостаточности по наличию задержки развития плода (ЗРП).
· Плацентарная недостаточность без ЗРП.
· Плацентарная недостаточность с ЗРП.
ЭТИОЛОГИЯ (ПРИЧИНЫ) ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Плацентарную недостаточность относят к полиэтиологическим заболеваниям.
Причины плацентарной недостаточности.
Среди них условно выделяют эндо и экзогенные.
· Эндогенные причины. Они вызывают различные варианты нарушения плацентации и созревания ворсин, при которых может развиваться сосудистая и ферментативная недостаточность, что приводит к формированию первичной плацентарной недостаточности.
· Экзогенные причины. К ним относят значительное число разнообразных факторов, действие которых приводит к нарушению маточноплацентарного и плодовоплацентарного кровообращения. В результате их влияния формируется чаще всего вторичная плацентарная недостаточность.
Причины первичной плацентарной недостаточности:
· генетические факторы;
· бактериальные и вирусные инфекции;
· эндокринные факторы (гормональная недостаточность яичников и др.);
· ферментативная недостаточность децидуальной ткани, которая выполняет роль питательной среды для развивающегося плодного яйца.
Перечисленные факторы приводят к анатомическим нарушениям строения, расположения, прикрепления плаценты, а также к дефектам ангиогенеза и васкуляризации, нарушению дифференцировки ворсин хориона. Совокупность патологических процессов, обусловливающих развитие первичной плацентарной недостаточности, часто наблюдают при невынашивании беременности, особенно привычном, и беременности, наступившей после бесплодия.
Причины вторичной плацентарной недостаточности. Она развивается при акушерских заболеваниях и осложнениях беременности.
Исследования последних лет доказали условность деления плацентарной недостаточности на первичную и вторичную. Первичная плацентарная недостаточность в большом проценте случаев может переходить во вторичную, а вторичная плацентарная недостаточность часто формируется на фоне субклинических патологиче-ских процессов на ранних этапах беременности. Скрытые нарушения плацентации могут служить причиной раннего возникновения клинических проявлений плацентарной недостаточности и её тяжёлого течения во второй половине беременности. Так происходит при наличии у беременной акушерских заболеваний и осложнений беременности, таких, как гестоз, угрожающее прерывание беременности, многоплодие; экстрагенитальных заболеваний (гипертонической болезни, заболеваний сердца и почек, СД).
В связи с многочисленностью, разнообразием и неоднозначностью действия этиологических факторов, способных вызвать развитие плацентарной недостаточности, выделяют факторы риска развития плацентарной недостаточности: социальнобытовые, акушерскогинекологические и экстрагенитальные заболевания, врождённую и наследственную патологию у матери и плода, внешние факторы.
Факторы риска развития плацентарной недостаточности:
· социально-бытовые факторы: возраст матери более 30 и менее 18-ти лет, недостаточное питание, тяжёлый физический труд, психоэмоциональные перегрузки, наличие профессиональных вредностей, курение, употребление алкоголя и наркотиков;
· экстрагенитальные заболевания: заболевания сердечно-сосудистой системы, почек, лёгких, болезни системы крови, СД;
· акушерско-гинекологические факторы:
- анамнестические (нарушение менструальной функции, бесплодие, невынашивание беременности, рождение недоношенных детей);
- гинекологические (аномалии половой системы, миома матки);
- акушерские и экстрагенитальные заболевания во время настоящей беременности (гестоз, угроза прерывания беременности, многоплодие, аномалии расположения и прикрепления плаценты, инфекции, в том числе урогенитальные, АФС, аллоиммунные цитопении);
· врождённая и наследственная патология у матери или плода;
· внешние факторы: ионизирующее излучение, физические и химические воздействия, в том числе лекарственных средств.
К наиболее значимым факторам риска развития плацентарной недостаточности относят гестоз и сочетание беременности с экстрагенитальной патологией, сопровождающейся поражением сосудов. Различные этиологические факторы, воздействуя на разных этапах развития и функционирования плаценты, в итоге вовлекаются в общий патогенетический механизм, приводящий к развитию синдрома плацентарной недостаточности, одним из основных проявлений которого рассматривают нарушение плацентарного кровообращения - основной функции плаценты.
ПАТОГЕНЕЗ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Основную роль в патогенезе плацентарной недостаточности отводят нарушению маточноплацентарной перфузии, что приводит к снижению транспорта кислорода и питательных веществ через плаценту к плоду. Возникновение гемодинамических расстройств в плаценте связывают с нарушениями морфологических и биохимических адаптивных реакций в плаценте при физиологической беременности. Поскольку развитие структур и функций плаценты происходит поэтапно, патологические изменения, происходящие в плаценте, зависят от характера и времени воздействия неблагоприятных факторов.
Этапы нарушения маточно-плацентарного кровообращения: нарушение эндоваскулярной миграции трофобласта, недостаточность инвазии вневорсинчатого хориона, нарушение дифференцировки ворсин плаценты.
· Нарушение эндоваскулярной миграции трофобласта в I триместре беременности приводит к задержке формирования маточноплацентарного кровообращения с образованием некротических изменений плацентарного ложа, вплоть до его полного отграничения, и последующей гибели эмбриона.
· Недостаточность инвазии вневорсинчатого хориона приводит к неполному преобразованию спиральных артерий, что рассматривают одним из основных механизмов редукции маточноплацентарного кровообращения с развитием гипоплазии плаценты и гипотрофии плода. В результате этого часть спиральных артерий не трансформируется на протяжении всей своей длины, у другой части - преобразования происходят только в их децидуальных сегментах, не затрагивая миометральные, что сохраняет способность сосудов отвечать на вазоконстрикторные стимулы.
· Нарушения дифференцировки ворсин плаценты имеют большое значение в патогенезе плацентарной недостаточности. Они проявляются их замедленным развитием, преждевременным старением или неравномерным созреванием с наличием в плаценте ворсин всех типов. При этом нарушаются процессы формирования синцитиокапиллярных мембран и/или происходит утолщение плацентарного барьера за счёт накопления в базальном слое коллагена и отростков фибробластов, на фоне которого затрудняются процессы обмена веществ через плацентарную мембрану.
Факторы, способствующие нарушению маточно-плацентарной перфузии: акушерские и экстрагенитальные заболевания матери, при которых происходит снижение притока крови в межворсинчатое пространство (гестоз, гипертоническая болезнь и др.), замедление кровотока в нём на фоне затруднения оттока крови и лимфы (гестоз и сердечно-сосудистые заболевания с отёчным синдромом, угроза прерывания беременности при длительно повышенном тонусе матки), повышение вязкости крови.
Последствия нарушения маточно-плацентарного кровообращения. Нарушение маточноплацентарного кровотока приводит к ишемии, нарушению микроциркуляции, отложению иммунных комплексов в трофобласте, нарушению его структуры, дисбалансу между разветвляющим и неразветвляющим ангиогенезом, нарушению транспорта кислорода и питательных веществ через плаценту и доставки кислорода к плоду.
· Ишемия. Снижение объёмной скорости кровотока в межворсинчатом пространстве приводит к ишемии, в условиях которой происходит активация системы перекисного окисления липидов с образованием свободных кислородных радикалов, высвобождению из активных нейтрофилов эластазы, что вызывает повреждение эндотелия сосудов. В эндотелии происходит снижение синтеза цитопротекторов и вазодилятаторов: простациклина и эндотелиального фактора релаксации (оксида азота).
· Нарушение микроциркуляции. Выделение повышенного количества тканевого тромбопластина, усиливающего агрегацию и адгезию тромбоцитов, увеличивается синтез тромбоцитарного тромбоксана А2 и эндотелина, обладающего вазоконстрикторным действием. Происходит патологическое увеличение индекса тромбоксан/простациклин. В участках повреждения эндотелия откладывается фибрин, липидные депозиты, возрастает число рецепторов, связывающих вазопрессорные вещества, что приводит к повышению резистентности сосудов, на фоне которой снижается маточноплацентарный кровоток.
· Отложение иммунных комплексов в трофобласте. При дальнейшем нарушении процессов микроциркуляции в тканях плаценты клетки повреждённого эндотелия, выполняющие роль Аг, стимулируют выработку АТ с отложением иммунных комплексов под эндотелием сосудов трофобласта.
· Нарушение структуры синцитиотрофобласта. В дальнейшем под влиянием цитотоксических веществ ещё больше замедляется ток крови в межворсинчатом пространстве, что способствует более выраженному повреждению эндотелия. Таким образом, формируется «порочный круг» расстройств гемодинамики в плаценте.
· Дисбаланс между разветвляющим и неразветвляющим ангиогенезом. На стадии развития ворсинчатого дерева умеренная гипоксия способна стимулировать пролиферативную способность цитотрофобласта, транскрипцию сосудистого эндотелиального фактора, ангиогенез ветвистого типа с развитием избыточной капилляризации ворсин.
При этом увеличивается масса плаценты, за счёт чего компенсируется недостаточная маточноплацентарная перфузия и длительно сохраняется нормальная сосудистая резистентность в ткани плаценты. Однако в большинстве случаев под влиянием гипоксии происходит стимуляция плацентарного фактора роста, что приводит к снижению интенсивности ангиогенеза ветвистого типа, который приходит на смену неразветвляющему ангиогенезу, с формированием выраженного дефицита капилляров ворсин. В результате отсутствует баланс между разветвляющим и неразветвляющим ангиогенезом, который во второй половине беременности поддерживает нормальное развитие сосудистой сети плаценты.
· Нарушение плацентарного ангиогенеза и отсутствие формирования нормального ворсинчатого дерева приводит к расстройствам кровообращения (возникают рано), что обусловливает раннее развитие ЗРП. Дефицит обменной поверхности плаценты образуется в основном за счёт снижения числа артериол третичных ворсин как вследствие их недостаточного образования, так и облитерации вследствие тромбоэмболических и вазоспастических процессов.
Плацента характеризуется высоким уровнем обмена веществ и потребляет более половины всего кислорода и более четверти от общего количества глюкозы, поступающих из материнского кровотока, поэтому при недостаточном маточноплацентарном кровообращении в первую очередь повреждается именно она.
· Нарушение транспорта кислорода и питательных веществ через плаценту. Транспорт кислорода и веществ через плаценту осуществляется по-средством двух основных механизмов: диффузии и активного транспорта.
Способность плаценты к транспорту возрастает с увеличением срока беременности, что обусловлено процессами созревания и дифференцировки трофобласта. Транспортная функция зависит от интенсивности маточно-плацентарного и плодовоплацентарного потока, проницаемости плацентарного барьера, состояния систем активного транспорта, уровня плацентарного метаболизма, обмена веществ у матери и плода.
Нарушение диффузии. Доставка к плоду кислорода и углекислого газа происходит путём простой или облегченной диффузии и зависит от интенсивности кровотока в межворсинчатом пространстве. Снижение оксигенации тканей плаценты приводит к энергетическому дефициту и вследствие этого нарушению систем активного транспорта.
Нарушение активного транспорта. Посредством активного транспорта осуществляется перенос через плацентарный барьер аминокислот, белков, пептидных гормонов, витаминов и других веществ.
В результате изменяется активность синтетических процессов в плаценте, которая на первых этапах характеризуется компенсаторной гиперпродукцией большинства ферментов, после чего сменяется их истощением. В большинстве случаев первично возникшее нарушение маточноплацентарной перфузии и ишемия в тканях плаценты приводят вторично к нарушению транспортной её функции и клеточно-паренхиматозной недостаточности, которая характеризуется изменением активности ферментов и состояния клеточного метаболизма. Однако в некоторых ситуациях, например, при нарушении дифференцировки ворсин, синтетическая функция плаценты может страдать первично.
· Нарушение доставки кислорода к плоду. В зависимости от выраженности снижения доставки к плоду кислорода выделяют три последовательных этапа этого хронического патологического процесса: гипоксемию, гипоксию и асфиксию.
Гипоксемия характеризуется снижением содержания кислорода в артериальной крови плода. В его организме последовательно развиваются адаптивные реакции.
– Стимуляция гемопоэза, в том числе экстрамедуллярного, вследствие чего развивается полицитемия, характеризующаяся увеличением количества циркулирующих эритроцитов и повышением уровня гематокрита.
– На начальных этапах в печени активируется глюконеогенез, однако снижается способность накапливать глюкозу в виде гликогена. Ограничивается транспорт глюкозы к плоду, что в условиях дефицита энергии приводит к постепенному нарушению механизмов активного транспорта в плаценте.
– При нарастании гипоксемии перераспределяется сердечный выброс: преимущественно снабжаются кровью жизненно важные органы (мозг, сердце, надпочечники).
– Снижение темпов роста плода вплоть до его полной остановки. Значительную роль в этих процессах играет дефицит инсулина в крови плода, отвечающий за перенос глюкозы через плаценту и её утилизацию в скелетной мускулатуре, печени и жировой ткани.
Гипоксия. В результате недостаточного содержания внутриклеточного кислорода, необходимого для аэробного метаболизма и выработки достаточного количества энергии, развивается «гипоксический стресс», сопровождающийся выбросом биологически активных веществ и гормонов, включая адреналин и норадреналин. Это приводит к ещё более выраженному перераспределению кровотока в сторону жизненно важных органов: активируются баро- и хеморецепторы аорты, возникает вазоконстрикция абдоминального отдела аорты, мезентериальных артерий и сосудов скелетных мышц. В результате нарастания гипоксии, гипогликемии и дефицита энергии метаболизм глюкозы переходит на анаэробный путь, который не способен компенсировать энергетический дефицит. Продукты анаэробного гликолиза способствуют развитию метаболического ацидоза.
Асфиксия. Дальнейшее нарастание выраженности патологического процесса приводит к развитию критического для выживания плода состояния. Возможна утрата механизмов, обеспечивающих централизацию плодового кровотока, вследствие чего нарушается кровоснабжение жизненно важных органов. При этом характер кровотока в периферических сосудах соответствует кровотоку в артерии пуповины - отсутствует поступательное движение крови в фазу диастолы или имеется ретроградный кровоток. В этих условиях поддерживать энергетический баланс жизненно важных органов возможно только непродолжительное время, по истечению которого клетки и ткани этих органов переходят на анаэробный путь метаболизма. Этот процесс характеризует начало заключительной фазы дефицита кислорода - асфиксии, на фоне которой возникают необратимые изменения в клетках жизненно важных органов, наступает окончательная декомпенсация, что приводит к гибели плода. ПН, сопровождающаяся серьёзными метаболическими и гемодинамическими расстройствами в функциональной системе мать-плацента-плод, приводит к развитию ЗРП - одной из основных причин перинатальной заболеваемости и ПС.
КЛИНИЧЕСКАЯ КАРТИНА (СИМПТОМЫ) ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
При хронической ПН беременные предъявляют жалобы, характерные для акушерских и экстрагенитальных заболеваний, на фоне которых развивается хроническая или острая ПН. Вместе с тем могут отмечать уменьшение числа шевелений плода. При острой ПН в родах могут наблюдаться клинические симптомы ПОНРП.
ДИАГНОСТИКА ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
АНАМНЕЗ
При сборе анамнеза выясняют анамнестические данные, которые можно отнести к материнским, плодовым или плацентарным факторам риска по развитию ПН (см. раздел «Этиология»). Особое внимание следует обращать на наличие клинических симптомов угрожающего прерывания беременности, гестоза.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ ПРИ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Беременные группы риска по развитию ПН нуждаются в регулярном клиническом наблюдении. При акушерском осмотре следует обращать внимание на следующие признаки:
· рост и вес беременной;
· окружность живота, ВДМ (если разность численного значения срока беременности и ВДМ, выраженной в сантиметрах, более трёх, можно говорить о наличии ЗРП; этот критерий позволяет выявить около 50% беременностей, осложнённых ЗРП);
· тонус матки (повышен при угрозе прерывания беременности);
· наличие кровянистых выделений из половых путей;
· число шевелений плода, характер сердцебиения при аускультации (глухость сердечных тонов и изменение частоты сердцебиения).
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ ПРИ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Они имеют диагностическое значение для выявления у пациенток групп риска, не имеющих гипотрофии плода, компенсированной ПН в III триместре беременности. Лабораторные исследования направлены на оценку гормональной функции плаценты:
· определение в сыворотке крови общей и плацентарной щелочной фосфатазы с последующим определением её доли в общей фосфатазной активности;
· определение в сыворотке крови содержания ПЛ и окситоциназы;
· исследование экскреции с мочой эстриола.
Помимо вышеперечисленных исследований, проводят лабораторную диагно-стику в соответствии с алгоритмом обследования тех акушерских и экстрагенитальных заболеваний, на фоне которых развился синдром ПН.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ ПРИ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Наиболее часто среди инструментальных методов для диагностики ПН используют УЗИ и КТГ. Ультразвуковые методы играют ведущую роль в диагностике ПН и ЗРП. Во II и III триметре беременности в сроки ультразвукового скрининга (20–24 нед и 30–34 нед), а также по дополнительным показаниям выполняют ультразвуковую фетометрию и допплерометрическое исследование кровотока в артериях и венах функциональной системы мать–плацента–плод.
При проведении УЗИ, помимо фетометрии, которая позволяет установить диагноз ЗРП, следует обратить внимание на следующие характеристики:
· определение расположения плаценты, её толщины и структуры (степень зрелости, наличие отёка, расширения межворсинковых пространств и др.);
· выявление мало- или многоводия (измерение наибольшего вертикального кармана или вычисление индекса АЖ);
· выявление ультразвуковых признаков тех акушерских и экстрагенитальных заболевания, которые лежали в основе развития плацентарной недостаточности;
· исследование и оценка в баллах биофизического профиля плода (при наличии оборудования). Выполняют оценку так называемой реактивности ЧСС плода по данным КТГ (наличие моторнокардиального рефлекса), частоте дыхательных движений, общей двигательной активности, тонуса, объёма ОВ. При нормальном функциональном состоянии плода суммарная оценка его биофизического профиля составляет 10 баллов.
Допплерометрическое исследование кровотока в артериях и венах функциональной системы мать-плацента- плод считают основным диагностическим методом, результаты которого характеризуют состояние плацентарного кровообращения и его соответствие потребностям плода на протяжении II и III триместра беременности. Отсутствие нарушений маточноплацентарного и плодовоплацентарного кровообращения свидетельствуют о нормальном функционировании плаценты.
· Исследование кровотока в артериях. Чаще всего исследуют кровоток в маточных артериях, артерии пуповины, средней мозговой артерии плода.
Исследуемые сосуды.
– Маточные артерии. Для нарушения кровообращения характерно снижение диастолического компонента на кривой скорости кровотока. В основе формирования патологических кривых скорости кровотока в маточных артериях лежит неполная инвазия трофобласта в спиральные артерии, что приводит к повышению резистентности в бассейне маточных артерий.
– Артерия пуповины. Патологические кривые скорости кровотока в артерии пуповины, единственным периферическим руслом которой выступает сосудистая сеть плодовой части плаценты, заключаются в снижении диастолического компонента на кривой скорости кровотока, как и в маточной артерии. Повышение сосудистого сопротивления плаценты обусловлено поражением микрососудов ворсин.
– Средняя мозговая артерия плода. Наиболее изученный мозговой сосуд плода - средняя мозговая артерия. Её кривая скорости кровотока имеют вид, характерный для сосудистой системы высокой резистентности. Патологические кривые в средней мозговой артерии (в отличие от таковых в пуповине и маточных артериях) характеризуются повышением диастолической скорости кровотока (так называемая централизация).
Показатели для оценки характера кривой скорости кровотока. Для оценки характера кривой скорости кровотока рассчитывают один из нижеперечисленных показателей сосудистого сопротивления.
– Систоло-диастолическое отношение.
– Индекс резистентности.
– Пульсационный индекс.
Патологическими принято считать значения, выходящие за пределы 90% для срока беременности.
– Церебро-плацентарное отношение - значение отношения ИР в средней мозговой артерии к ИР в артерии пуповины, которое в физиологических условиях превышает 1,0. Снижение этого показателя менее 1,0 свидетельствует о перераспределении плодового кровотока в сторону жизненно важных органов, в первую очередь мозга (феномен централизации плодовоплацентарного кровообращения).
Наличие изменений параметров гемодинамики при допплерографии не тождественно гипоксии. С большой вероятностью можно говорить о гипоксии при регистрации так называемых критических показателей плодово- плацентарного кровообращения (при нулевом и реверсном диастолическом кровотоке в артерии пуповины антенатальная смертность составляет около 50%).
· Исследование кровотока в венах. В случае регистрации критических значений кровотока в артериях плодово- плацентарной циркуляции, исследуют венозное кровообращение в этой системе. Выполняют допплерографические исследования вены пуповины, венозном протоке, нижней полой и яремных венах плода.
Неблагоприятные признаки нарушения венозного кровообращения (патологические кривые скорости кровотока)
– Вена пуповины. Сохранение её пульсации после 16-й нед беременности. Признак свидетельствует о сердечно- сосудистой декомпенсации у плода.
– Венозный проток. Отсутствие ортоградного кровотока во все фазы сердечного цикла, что указывает на нарушение
оксигенации жизненно важных органов.
– Нижняя полая вена плода. Нарушение оттока крови из нижней половины туловища плода.
– Яремные вены плода. Нарушение оттока крови из верхней половины туловища плода.
Кардиотокография
Диагностические критерии разработаны для беременности сроком 32 нед и более (см. главу «Инструментальные неинвазивные методы исследования»).
· Наиболее значимые диагностические критерии нарушения функционального состояния плода при беременности:
Снижение амплитуды моторнокардиального (миокардиального) рефлекса и/или
- снижение амплитуды осцилляций сердечного ритма.
Необходимо помнить, что снижение амплитуды можно наблюдать не только при нарушении функционального состояния плода, но и в связи с выполнением записи в период спокойного состояния плода в цикле активность-покой, патологической незрелостью ЦНС плода на фоне плацентарной недостаточности, приёмом лекарственных средств беременной.
· Основной диагностический признак нарушения функционального состояния плода в родах - характер реакции сердечного ритма плода на схватку.
· Исследование циклической организации функциональных состояний (становление цикла «активность-покой»). В физиологических условиях цикл «активность-покой» формируется к 34–35 нед беременности. Задержка или отсутствие формирования цикла свидетельствует о нарушении функционального состояния ЦНС плода (задержка созревания её координирующей и интегрирующей функции) на фоне плацентарной недостаточности.
СКРИНИНГ
Ультразвуковую диагностику за время беременности необходимо выполнять 3-кратно в сроки 11–14, 20–24 и 32– 34 нед.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Необходимость консультаций зависит от акушерской и экстрагенитальной патологии, на фоне которой развивается плацентарная недостаточность.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА ПРИ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
ПОНРП. Острая плацентарная недостаточность. Гипоксия плода.
Хроническая компенсированная плацентарная недостаточность.
Хроническая компенсированная плацентарная недостаточность. ЗРП.
Хроническая декомпенсированная плацентарная недостаточность. I степень гемодинамических нарушений.
Хроническая декомпенсированная плацентарная недостаточность. Критические нарушения плодовоплацентарного
кровотока. ЗРП.
ЛЕЧЕНИЕ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
ЦЕЛИ ЛЕЧЕНИЯ
Развитие плацентарной недостаточности связано с морфологическими изменениями в плаценте, на фоне которых возникают, прежде всего, гемодинамические расстройства, поэтому достигнуть излечения этих процессов невозможно. Основная цель лечения заключается в пролонгировании беременности и своевременном родоразрешении.
· Пролонгирование беременности осуществляют за счёт оптимизации кровообращения и коррекции расстройств метаболизма в плаценте при наличии значительной незрелости плода (до 34 нед беременности) и невозможности оказать ему адекватную неонатальную помощь после родов.
· Своевременный выбор срока и метода родоразрешения при достижении плодом жизнеспособного для внеутробного существования срока (как правило, после 34 нед беременности). Для этого требуется адекватная диагностика степени нарушения плацентарной функции.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ ПРИ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Показания к госпитализации в акушерский стационар определяют индивидуально с учётом сопутствующей патологии.
Выделяют показания во время беременности и перед родоразрешением.
· Показания во время беременности:
- декомпенсация (по данным допплерометрии) плацентарного кровообращения независимо от её степени;
- нарушение функционального состояния плода, выявленное другими диагностическими методами;
- наличие ЗРП.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Терапия плацентарной недостаточности в большой мере определяется необходимостью устранения причин нарушения кровообращения в плаценте. У пациенток с угрозой прерывания важным компонентом лечения плацентарной недостаточности является снижение тонуса маточной мускулатуры; при гестозе – устранение ангиоспазма и улучшение микро и макрогемодинамики. Важно также осуществлять патогенетически обоснованную терапию при таких заболеваниях, как гипертоническая болезнь, СД, АФС и др.
Комплексная патогенетическая терапия плацентарной недостаточности
В комплексную патогенетическую терапию плацентарной недостаточности включают, прежде всего, препараты, обладающие вазоактивным действием. С целью улучшение плодовоплацентарного кровообращения целесообразно примененять сочетание актовегина с b-адреномиметиками. Актовегин© назначают в виде внутривенных инфузий: 80–160 мг (2–4 мл) актовегина© в 200 мл 5% раствора глюкозы. Количество инфузий зависит от динамики допплерометрических показателей в плодовоплацентарной циркуляции (до 10 инфузий). В последующем возможно применять актовегин© и гексопреналин перорально: актовегин© в виде драже пролонгированного действия (200 мг) по 1 драже в сутки, гексопреналин 0,5 мг по 1/4–1/2 таблетки от двух до шести раз в день.
В последние годы широкое применение в акушерской практике для профилактики заболеваний, обусловливающих развитие плацентарной недостаточности и её лечения, применяют антиагреганты: дипиридамол, пентоксифиллин. К антиагрегантам, применяемым в акушерстве, предъявляются следующие требования:
· отсутствие тератогенного и эмбриотоксического действия;
· нормализация соотношения ПГ за счёт увеличения синтеза ПГ P- I2;
· улучшение микроциркуляции и плацентарного кровотока;
· отсутствие риска кровотечения и ослабления гипотензивного эффекта препаратов, применяемых для лечения гестоза.
Показания к приёму антиагрегантов:
· заболевания сердечно-сосудистой системы (пороки сердца, АГ, варикозная болезнь вен нижних конечностей);
· хронические заболевания почек и печени;
· тромбофлебит и тромбоз венозных сосудов;
· эндокринные заболевания (СД и др.);
· АФС;
· ДВС-синдром.
Наиболее безопасный антиагрегант и ангиопротектор - дипиридамол. Его можно применять в любые сроки беременности и комбинировать с гипотензивными препаратами, ацетилсалициловой кислотой, гепарином. Он улучшает микроциркуляцию в плаценте за счёт увеличения интенсивности коллатерального кровотока, повышения синтеза P- I2, снижения активации и агрегации тромбоцитов. Препарат как средство профилактики и лечения плацентарной недостаточности у беременных с гестозом назначают в дозах 75–225 мг/сут. Его максимальная суточная доза составляет 450 мг. При приёме дипиридамола отсутствует опасность передозировки и развития кровотечений, поэтому препарат можно применять вплоть до родоразрешения, а при необходимости начиная с первых дней после родов.
При сочетании беременности с тяжёлыми формами инсулинзависимого СД, а также у женщин, у которых причиной неблагоприятных исходов беременностей служит АФС, эффективными средствами для профилактики и лечения плацентарной недостаточности являются низкомолекулярные гепарины и гепариноиды (фраксипарин, сулодексид). Сроки проведения и длительность терапии этими препаратами в каждом случае следует подбирать индивидуально. Кроме того, при АФС в качестве основных средств, кроме антиагрегантов и низкомолекулярных гепаринов, применяют внутривенное введение иммуноглобулинов, а в качестве дополнительной терапии рекомендуют прием рыбьего жира и вобэнзима ©.
В последнее время предпочтение отдают препаратам комбинированного вазоактивного и метаболического типа.
Например, при нарушениях гемодинамики в функциональной системе мать-плацента-плод в/в капельно назначают 5,0 мл 10% раствора триметилгидразиния пропионата в 200 мл 0,9% рра NaCl или 5% раствора глюкозы, предпочтительно в сочетании с введением 5,0 мл 5% аскорбиновой кислоты. Препарат обладает нейропротективным эффектом, не обладает эффектом «обкрадывания»; действие его обратимо.
СРОКИ И МЕТОДЫ РОДОРАЗРЕШЕНИЯ
Основная причина острой и хронической гипоксии плода, а также рождения детей с неврологическими нарушениям - плацентарная недостаточность, поэтому выбор оптимальных сроков и способа родоразрешения женщин с данной патологией позволяет существенно снизить перинатальные потери.
При выявлении симптомов нарушения функционального состояния плода по клиническим, лабораторным и инструментальным данным до наступления родовой деятельности вопрос о сроках и способе родоразрешения решают индивидуально с учётом, прежде всего, тяжести выявленных нарушений, готовности родовых путей к родам и совокупности акушерских и экстрагенитальных заболеваний беременной.
Показания для досрочного прерывания беременности (при сроке беременности более 30–32 нед):
· критические нарушения плодовоплацентарного кровотока;
· III степень нарушений в функциональной системе мать-плацента-плод.
Перинатальные исходы при более раннем родоразрешении сомнительны. Метод выбора для родоразрешения в интересах плода - кесарево сечение. При выявлении симметричной формы ЗРП в первую очередь следует исключить ошибку в определении гестационного срока, а затем - исключить наличие хромосомной патологии у плода. При наличии плацентарной недостаточности с гемодинамическими нарушениями I–II степени нецелесообразно пролонгировать беременность свыше 37 нед.
Показания к досрочному прерыванию беременности при неэффективности пролонгирования беременности (до 37-й нед беременности):
· отсутствие положительной динамики показателей фетометрии и/или допплерометрии после 10-дневного курса лечения плацентарной недостаточности;
· гипотрофия плода.
При отсутствии биологической готовности мягких родовых путей к родам, наличии ЗВРП с признаками нарушения функционального состояния плода у первородящих старшего возраста, имеющих отягощенный акушерско- гинекологический анамнез, методом выбора для родоразрешения является операция кесарево сечение.
Показания для ведения родов через естественные родовые пути: благоприятная акушерская ситуация и удовлетворительные показатели состояния плода (по данным УЗИ, КТГ, допплерометрии, функциональных нагрузочных проб).
При этом основное внимание следует уделить своевременной подготовке родовых путей (ламинарии, динопростон), мониторному наблюдению за состоянием плода, адекватному обезболиванию.
Если планируется ведение родов через естественные родовые пути, проводят родовозбуждение с ранней амниотомией под постоянным мониторным наблюдением за функциональным состоянием плода с применением прямой КТГ. При необходимости в родах целесообразно проводить пробу Залинга.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
· Фетометрические показатели определяют 1 раз в две недели.
· Частота выполнения допплерометрического исследования сосудов функциональной системы мать–плацента–плод зависит от степени гемодинамических нарушений.
· Динамическое наблюдение за функциональным состоянием плода методом КТГ осуществляют не реже, чем один раз в неделю.
ПРОФИЛАКТИКА ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Она включает широкий спектр медикментозных и немедикаментозных мероприятий.
· Лечение акушерских и экстрагенитальных заболеваний, предрасполагающих к развитию плацентарной недостаточности.
· Регуляция тканевого обмена и окислительно-восстановительных процессов у беременных групп риска по развитию плацентарной недостаточности. С этой целью назначают антиоксиданты (a-токоферола ацетат, аскорбиновую кислоту), гепатопротекторы (эссенциале©, экстракт листьев артишока [хофитол©]).
· Нормализация процессов возбуждения и торможения в ЦНС у беременных с астенической конституцией и повышенным уровнем тревожности. Для этого используют ноотропы (пирацетам); глицин, оказывающий значительный антистрессовый эффект.
· При вегетососудистой дистонии по гипотоническому типу хороший эффект оказывают адаптогены (настойка лимонника, элеуторококка, женьшеня, аралии).
· Для нормализации сна используют комплексные фитопрепараты, содержащие экстракты валерианы, боярышника, мелиссы, хмеля, перечной и лимонной мяты: ново-пассит©, лекарственной корневищ с корнями настойка + мелиссы лекарственной травы экстракт + мяты перечной, валерианы лекарственной корневищ с корнями настойка + хмеля шишек экстракт.
Лечебно-профилактические мероприятия должны включать диетотерапию, витаминотерапию, продукты и пищевые добавки, стимулирующие функцию кишечника (кисломолочные продукты, хлеб из муки грубого помола, ламинолакт).
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Плацентарная недостаточность - грозное осложнение беременности, приводящее к высокой заболеваемости и смертности плода и новорождённого. Поскольку причины её развития - заболевания матери (сердечно-сосудистые заболевания, заболевания почек, СД), в механизме развития которых имеют значение сосудистые нарушения, целесообразно проводить обследование и лечение этой патологии при планировании беременности. Существенно возрастает риск развития плацентарной недостаточности у курильщиц, пациенток, употребляющих алкоголь и наркотики.
ПРОГНОЗ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
Благоприятный при лёгкой степени гемодинамических расстройств в функциональной системе мать–плацента–плод.
Сомнительный при выраженной гипотрофии и тяжёлых нарушениях гемодинамики.